
��֪��������������л�������A����Է�������Ϊ92.5������̼���⡢������Ԫ�أ��������������Ϊ9.73%��
��A�����µ�ת����ϵ

�����ǻ�������̼��û����ԭ�ӵĴ����ṹ��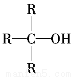 ������������ȩ��ͪ��
������������ȩ��ͪ��
����F�ĺ˴Ź����������������շ壬������֮��Ϊ9��1��
����E��G���ܺ����Ƶ�Cu��OH��2����Һ��Ӧ������Ӧ���Ͳ�ͬ��H��һ�־��й���ζ��Һ�塣
����������Ϣ�ش���������
��1��A�Ľṹ��ʽΪ______________________��
��2����Ӧ�ߵķ�Ӧ����Ϊ_____________________��
��3��D����������ͬ����ͬ���칹���ڢ���û�г��֣����ǵ����Ʒֱ�Ϊ______________________________________��______________________________________��
��4����B��ͬ���칹���д���˳���칹������д���䷴ʽ�칹��Ľṹ��ʽ��___________��
��5��д�����з�Ӧ�Ļ�ѧ����ʽ��
E�����Ƶ�Cu��OH��2����Һ��Ӧ_____________________________________________��
��Ӧ��_____________________________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������ʮ���и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ť�۵�����ִ��������й㷺Ӧ�ã���һ����п��أ���缫�ֱ���Ag2O��Zn���������ҺΪKOH���缫��ӦΪ��Zn+2OH����2e=ZnO+H2O��Ag2O+H2O+2e=2Ag+2OH��������������Ӧʽ���ж�������������ȷ���ǣ� ��
A����ʹ�ù����У���ظ�������Һ��pH��С
B��ʹ�ù����У�������Ag20�������·����Zn��
C��Zn�Ǹ�����Ag2O������
D��Zn�缫������ԭ��Ӧ��Ag2O�缫����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꺣��ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
25�桢101 kPa�£�2g����ȼ������Һ̬ˮ���ų�285.8kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ����
A��2H2(g)+O2(g)==2H2O��1�� ��H= �D285.8kJ��mol
B��2H2(g)+ O2(g)==2H2O��1�� ��H= +571.6 kJ��mol
C��2H2(g)+O2(g)==2H2O(g) ��H= �D571.6 kJ��mol
D��H2(g)+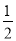 O2(g)==H2O��1�� ��H = �D285.8kJ��mol
O2(g)==H2O��1�� ��H = �D285.8kJ��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�ܱ������н��з�Ӧ��2SO2��g����O2��g��  2SO3��g������֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol��L��1��0.1 mol��L��1��0.2 mol��L��1������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ������ǣ� ��
2SO3��g������֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol��L��1��0.1 mol��L��1��0.2 mol��L��1������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ������ǣ� ��
A��SO2Ϊ0.4 mol��L��1��O2Ϊ0.2 mol��L��1
B��SO3Ϊ0.4 mol��L��1
C��SO2��SO3��Ϊ0.15 mol��L��1
D��SO2Ϊ0.25 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б仯��˷���ͬ�������������ǣ� ��
A���Ȼ�����Ȼ��ص��ܽ� B�����NaCl���ۻ�
C����ɱ������� D�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л�������γ�˳���칹���ǣ� ��
A����ϩ
B��2-��-2-��ϩ
C��1-��-1-��ϩ
D��2,3-����-2-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ֲ�ͬ����CxHy��CaHb������ʲô������ϣ�ֻҪ������һ������ȫȼ��ʱ����O2������������ˮ���������䣬����������ȷ���ǣ� ��
A��CxHy��CaHb��������ԭ��ϵ��һ�����
B��������C2H4��C3H6�Ļ����
C��CxHy��CaHbһ����ͬ���칹��
D��CxHy��CaHb�����ʽ���Բ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�����и߶�ѡ����ѧ����ĩ���л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼʾ���Ӧ�����������
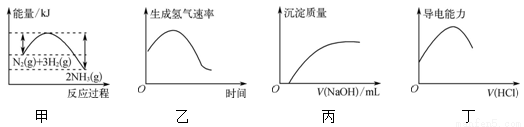
A����Ӧ�ﵽƽ��������¶ȣ�ƽ�������ɰ����ķ����ƶ�
B���ұ�ʾþ�����������������������������¶Ⱥ�Ũ�ȵ�Ӱ��
C������ʾ��Ca��HCO3��2��Һ�е���NaOH��Һ���ó����������仯
D������ʾ��ˮ��ͨ��HCl���壬��Һ�ĵ��������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������������һ�и�һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
I������ᣨH2C2O4����Һ�еμ������ữ���������Һ���о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬����д���÷�Ӧ�Ļ�ѧ����ʽ ��
II��ijͬѧ������������Ի�ѧ��Ӧ���ʵ�Ӱ��ԭ�����������������������ᷴӦ�й�ʵ�飬
ʵ����̵����ݼ�¼���±������ϱ�����Ϣ���ش��й����⣺
ʵ����� | ��Ӧ�¶�(��) | �μӷ�Ӧ������ | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/ml | c/mol��L��1 | V/ml | c/mol��L��1 | V/ml | ||
A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
��1��д��������Ӧ�����ӷ���ʽ ��
��2������˵���¶ȶԸ÷�Ӧ����Ӱ�����ϱȽ��� ������ʵ����ţ�
��A��B��A��C����ϱȽ����о��������� ��
��3���̲��������˳��ֻ�ɫ�����Ŀ������ȽϷ�Ӧ���ʵĿ������������Ϊ�β�������ˮ��������λʱ������������Ĵ�С�Ŀ���ԭ�� ��
���𰸡�I��5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+10CO2��+8H2O ��
II����1��S2O32-+2H+�TS��+SO2+H2O����2��BD ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻
��3�����������������ˮ��1���ˮ���ܽ�40��������������Ե��²ⶨ����ȷ���Ҹ�ʵ��װ�ýϸ��ӣ������ƣ����Բ�������ˮ��������λʱ������������Ĵ�С���бȽϡ�
��������
���������I��������л�ԭ�ԣ����Ը��������Һ����ǿ�������ԣ���Ѳ�������ΪCO2��������ر���ԭ����Mn2+�����ݵ����غ��ԭ���غ㣬�ɵ���H2C2O4����Һ�еμ������ữ���������Һ��������Ӧ�Ļ�ѧ����ʽΪ5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+10CO2��+8H2O��II����1����������������ᷢ����Ӧ���������ơ������������ʼ�ˮ����Ӧ�����ӷ���ʽ��S2O32-+2H+�TS��+SO2+H2O����2������˵���¶ȶԸ÷�Ӧ����Ӱ���ʵ��Ӧ��������������ͬ��ֻ�з�Ӧ���¶Ȳ���ͬ����ϱȽϺ�������BD����A��B��A��C�����������������ͬ��ֻ�����ʵ�Ũ�Ȳ���ͬ����˱Ƚ����о���������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻��3������S�Dz�����ˮ�����ʣ����Խ̲��������˳��ֻ�ɫ�����Ŀ������ȽϷ�Ӧ���ʵĿ��������ڶ��������������ˮ��1���ˮ���ܽ�40��������������Ե��²ⶨ����ȷ���Ҹ�ʵ��װ�ýϸ��ӣ������ƣ����Բ�������ˮ��������λʱ������������Ĵ�С���бȽϡ�
���㣺����������ԭ��Ӧ����ʽ����д�����ӷ���ʽ����д����Ӧ�����Ŀ��Ƽ���ѧʵ�鷽������������۵�֪ʶ��
�����͡�ʵ����
���������
�����⡿����ǿУ��2015-2016ѧ��������������һ�и�һ����ĩ��ѧ�Ծ�����������
���ؼ��ֱ�ǩ��
��������
I��ijѧ����0.2000 mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
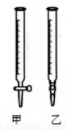
��������ˮϴ�Ӽ�ʽ�ζ��ܣ���ע��NaOH��Һ����0���̶�������
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ������Һ��
�۵���Һ������0����0���̶������£������¶���
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ
���ñ�Һ�ζ����յ㣬���µζ���Һ�����
��ش�
��1�����ϲ����д�����ǣ����ţ� ��
��2���ñ�NaOH��Һ�ζ�ʱ��Ӧ����NaOH��Һע��______�С�����ͼ��ѡ��ס����ҡ���
��3�����в���������ʵ����ƫ����ǣ�______�����ţ�
A������ƿװҺǰ��������������ˮ
B���ζ�ǰ���ζ��ܼ��������ݣ��ζ���������
C����ƿ��������ˮϴ�Ӻ�δ�ô���Һ��ϴ
D������ʽ�ζ�����ȡҺ��ʱ���ͷ�Һ��ǰ�ζ���ǰ�������ݣ�֮����ʧ
��4���ζ�ʱ�����ֿ��Ƶζ��ܣ�����ҡ����ƿ���۾�ע�� ���жϵ���ζ��յ�������ǣ���ƿ����Һ ��
��5��������ʵ�����ݼ�¼��
�ζ����� | �������mL | NaOH��Һ���������mL�� | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
ͨ������ɵã�������Ũ��Ϊ��______ mol•L-1������������4λС����
II�����ü�����ζ����ɲⶨBa2���ĺ�����ʵ����������С�
��֪��2CrO42����2H����Cr2O72����H2O Ba2����CrO42����BaCrO4��
����1����ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ��������ΪV0 mL��
����2����ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽��:1��ͬŨ�ȵ�Na2CrO4��Һ����Ba2����ȫ�������ټ������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ���������ΪV1 mL��
��BaCl2��ҺŨ��Ϊ______________________ mol��L��1��������2�еμ�����ʱ����������Һ��������Ba2��Ũ�ȵIJ���ֵ��___________���ƫ��ƫС������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com