
| A. | 反应时构成分子的原子种类发生改变 | |
| B. | 分子、原子、离子都是构成物质的微粒 | |
| C. | 不同元素最本质的区别在是相对原子质量不同 | |
| D. | 原子不显电性,是因为原子中不存在带电的粒子 |
分析 A.化学反应的最小微粒是原子;
B.分子、原子、离子是构成物质的微粒;
C.决定元素种类的是质子数或核电荷数;
D.原子核所带的电量和核外电子所带的电量相等.
解答 解:A.在化学反应前后原子种类是不变的,故A错误;
B.构成物质的基本微粒是分子、原子、离子,故B正确;
C.决定元素种类的是质子数或核电荷数,即不同元素最本质的区别在于质子数不同,故C错误;
D.原子不显电性,是因为原子核所带的电量和核外电子所带的电量相等,电性相反,所以整个原子不显电性,故D错误.
故选B.
点评 本题考查原子构成,难度不大,解答本题关键是要熟悉分子、原子的组成性质和结构,知道原子不显电性的原因,构成物质的基本微粒.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙炔与HCl加成 | D. | 乙醇与浓盐酸取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
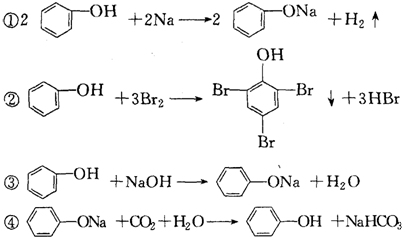
| A. | ①③ | B. | ②④ | C. | ② | D. | 都不可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下为液体 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 可自身加成形成聚乙烯 | D. | 能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)/c(H+)═10-12的溶液中:NH4+、Cu2+、NO3-、Cl-能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D微粒的结构示意图是
,D微粒的结构示意图是 ,写出E的三种核素11H、21H、31H.
,写出E的三种核素11H、21H、31H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
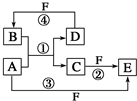 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).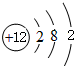 ,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com