
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
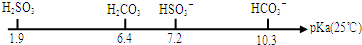
分析 (1)①反应能否自发进行根据公式△G=△H-T△S<0计算;
②反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生改变,由此衍生的一些物理量也不变,以此判断;
(2)①第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;
②利用三段式计算平衡时,各组分的物质的量,该反应是气体体积不变的反应,故利用物质的量代替浓度代入平衡常数表达式计算平衡常数;
(3)①根据pKa越小,电离平衡常数Ka越大,则对应酸的酸性就强,利用酸越弱则强碱弱酸盐的水解程度越大来分析;
②H2SO3与KOH以1:1的物质的量比反应生成KHSO3,利用KHSO3溶液呈酸性,则HSO3-的电离大于其水解来分析.
解答 解:(1)①由热化学反应方程式可知,反应为焓增,熵增过程,即△H>0、△S>0,△G=△H-T△S<0时反应能自发进行,较高温度下才能保证△G=△H-T△S<0;
故答案为:较高温度;
②A.无论反应是否达到平衡状态,都存在c(CO)=c(H2),故A错误;
B.1mol H-H键断裂的同时断裂2molH-O键,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C.反应在一个容积不变的密闭容器中进行,容器中的压强由气体的物质的量决定,当压强不变时,气体的物质的量就不变,气体的物质的量浓度也不变,说明达到平衡,故C正确;
D.消耗H2O的速率和生成H2的速率都指正反应速率,故D错误;
故答案为:BC;
(2)①实验1中CO的转化率为$\frac{4mol-2.4mol}{4mol}$×100%=40% 实验2中CO的转化率为 $\frac{2mol-1.6mol}{2mol}$×100%=20%则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;
故答案为:<;
②平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=$\frac{0.4×0.4}{1.6×0.6}$=0.17,
故答案为:0.17;
(3)①由pKa数据可知,亚硫酸的pKa小于碳酸,则酸性比碳酸的强,相同浓度的NaHSO3溶液比NaHCO3溶液中酸根离子的水解程度弱,则NaHSO3溶液的pH小,即bl<b2,故答案为:<;
②反应后溶液的溶质为KHSO3,又KHSO3溶液呈酸性,则HSO3-的电离大于其水解,电离生成SO32-离子,水解生成H2SO3,则c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),故答案为:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3).
点评 本题考查化学平衡计算以及化学平衡移动等问题以及溶液PH的大小比较、酸碱混合后溶液中的离子的浓度关系等,题目侧重于反应原理的应用,题目综合性较强,难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3、NH4NO3 | B. | (NH4)2CO3、NH4NO3 | C. | NH4HCO3、NH4Cl | D. | NH4Cl、(NH4)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

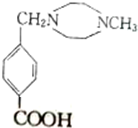 .
.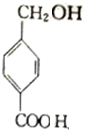 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$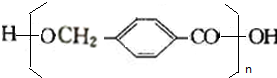 +(n-1)H2O
+(n-1)H2O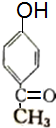 +2Br2→
+2Br2→ +2HBr.
+2HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
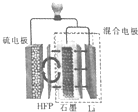 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
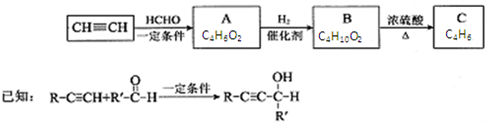
 ,其反应类型消去反应.
,其反应类型消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
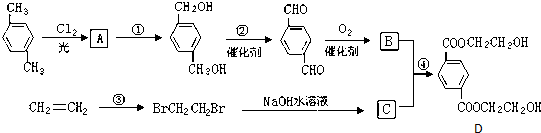
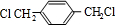 、
、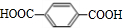 、HOCH2CH2OH.
、HOCH2CH2OH. +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$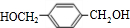 +2NaCl;水解(取代)反应.
+2NaCl;水解(取代)反应.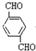 与银氨溶液反应的化学方程式OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O.
与银氨溶液反应的化学方程式OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O.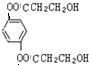 )与足量NaOH溶液反应的化学方程式:
)与足量NaOH溶液反应的化学方程式: +4NaOH→
+4NaOH→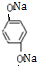 +2HOCH2CHCOONa.
+2HOCH2CHCOONa.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生吸氧或析氢腐蚀时,铁均作负极被氧化:Fe-3e-═Fe3+ | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+═2Fe2++4H++SO42- | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+ | |
| D. | Na2S溶液使酚酞变红:S2-+2H2O?2OH-+H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com