
有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放人2mol•L﹣1H2SO4溶液中,乙同学将电极放入2mol•L﹣1的NaOH溶液中,如图所示.
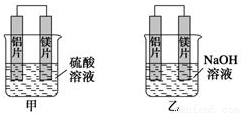
(1)甲池中,镁片上发生 (填“氧化”或“还原”)反应,硫酸根离子往 (填“正极”或“负极”)迁移;写出甲池中正极的电极反应式: .
(2)写出乙池中负极的电极反应式: .
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出活动性更强,而乙会判断出 活动性更强(填写元素符号).
(4)由此实验,以下结论正确的是 .
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析.
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为
A.1:1 B.5:1 C.1:5 D.3:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:实验题
在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在 式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从 色变为 色.
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第 种(填序号).
①2.500mol•L﹣1 ②0.25mol•L﹣1 ③0.025mol•L﹣1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)= .
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差.
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出
②滴定前读数时仰视,滴定完毕读数时俯视 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:选择题
用0.102 6mol•L﹣1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )

A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:选择题
把1L 0.1mol/L醋酸溶液用蒸馏水稀释到10L,下列叙述正确的是( )
A.c(CH3COOH)变为原来的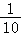
B.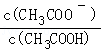 的比值增大
的比值增大
C.c(H+)变为原来的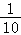
D.溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下第一次段考化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )

A.电池放电时Na+从a极区移向b极区
B.电极b采用Mn O2,Mn O2既做电极材料又有催化作用
C.该电池的负极反应为BH4-+8OH﹣一8e﹣═BO2-+6H2O
D.每消耗3molH2O2,转移的电子为3mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下第一次段考化学试卷(解析版) 题型:选择题
研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是( )
A. 比较这两种元素的单质的硬度和熔点
B. 在氯化铝和氯化镁的溶液中分别滴加过量的氨水
C. 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
D. 将空气中放置已久的这两种元素的单质分别和热水作用
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市名校高一下联考化学试卷(解析版) 题型:选择题
下列离子检验的方法正确的是( )
A.某溶液 有白色沉淀,说明原溶液中有Cl﹣
有白色沉淀,说明原溶液中有Cl﹣
B.某溶液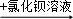 有白色沉淀,说明原溶液中有SO42﹣
有白色沉淀,说明原溶液中有SO42﹣
C.某溶液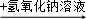 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液 生成无色气体,说明原溶液中有CO32﹣
生成无色气体,说明原溶液中有CO32﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下4月月考化学试卷(解析版) 题型:填空题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1
C原子的第一至第四电离能分别是:
I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol
D原子核外所有p轨道全满或半满
E元素的主族序数与周期数的差为4
F 是前四周期原子电子轨道表示式中单电子数最多的元素
G在周期表的第十一列
(1)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是 .
(3)①DE3中心原子的杂化方式为 杂化,该分子中的键角比离子DE4+中的键角小的原因是
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+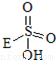 → +HE (请写出横线上物质的结构式)
→ +HE (请写出横线上物质的结构式)
(4)F位于 区,价电子排布式为 .
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为 .假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com