

| A. | 该反应是吸热反应 | |
| B. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 | |
| C. | 断裂1 mol A-A键和1 mol B-B键能放出x kJ能量 | |
| D. | 断裂2 mol A-B键需要吸收y kJ的能量 |
科目:高中化学 来源: 题型:选择题
| A. | 等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等 | |
| B. | 废弃的PE和PVC均可回收利用以减少白色污染 | |
| C. | 将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红 | |
| D. | PVC的单体可由PE的单体与氯化氢加成制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
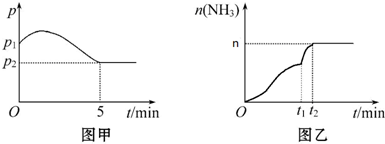
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
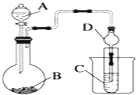 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H30 | B. | C15H32 | C. | C16H34 | D. | C17H36 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的小 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| D | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状碳 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
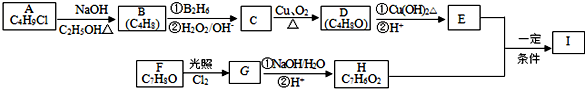
 ;
; ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com