
【题目】已知:X,Y,Z,W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X,Y,W位置如图所示(副族省略),X,Y,Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( ) 
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y,W的最高价氧化物对应的水化物能反应
【答案】BD
【解析】解:X、Y、Z的最高价氧化物对应的水化物相互能反应,则其中一种元素最高价氧化物的水化物是两性,根据元素在周期表中位置及原子半径知,Z元素位于Y元素之后,第二周期元素最高价氧化物的水化物呈强酸性的只有N元素,所以X是N元素,Y是Na元素、Z是Al元素、W是Si元素,
A.通过以上分析知,元素Z不处于周期表的阴影位置,位于W元素之前位置,故A错误;
B.同一周期元素,元素非金属性随着原子序数增大而增大,同一主族元素,元素非金属性随着原子序数增大而减弱,所以非金属性X>W,故B正确;
C.X是N元素、W是Si元素,二者形成的化合物是共价化合物,属于原子晶体,熔点很高,故C错误;
D.Y的最高价氧化物的水化物是NaOH,W的最高价氧化物的水化物是硅酸,二者发生酸碱中和反应,故D正确;
故选BD.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】将气体A、B置于体积为1L的密闭容器中,发生如下反应:4A(g)+B(g) =2C(g) 反应进行到4s末,测得A为0.5 mol,B为0.4 mol, C为0.2mol。则用v(A)表示的该反应的速率为________,用v(B)表示的该反应的速率为________,用v(C)表示的该反应的速率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的反应过程中的能量变化如图所示,下列说法正确的是( )

A. 热化学方程式: H2+F2===2HF,ΔH = -270 kJ/mol
B. 氟化氢气体分解生成氢气和氟气的反应是放热反应
C. 在相同条件下,1 mol H2 (g) 与1 mol F2 (g) 的能量总和大于2 mol HF (g) 的能量
D. 其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液980 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
A. 950 mL 111.2 g B. 500 mL 117.0g
C. 1000 mL 117.0 g D. 1000 mL 114.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( ) 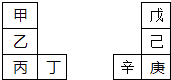
A.金属性:甲>乙>丁
B.原子半径:辛>戊>甲
C.丙与庚的元素原子核外电子数相差13
D.形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X,Y,Z,M四种元素均为短周期元素.有关信息如下表:
原子或分子结构、单质或化合物相关信息 | |
X | 含X元素的物质焰颜色反应为黄色 |
Y | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
Z | Z元素原子易失去2个电子形成8电子结构的离子 |
M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(1)X元素在周期表的位置是;
(2)1个Y单质分子中含对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为 .
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2 , 其溶液显黄色.则X2M2的电子式为 , 用化学方程式表示X2M溶液在空气中的变质过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
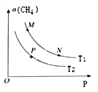
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N两点的H2的物质的量浓度c(M)______c(N)(填“>”“<”或“=”)。
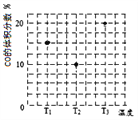
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
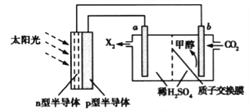
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,X基态原子s能级的总电子数比p 能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。回答下列问题:
(l)R、X、Y第一电离能由大到小的顺序是________(填元素符号),其中Y原子的价电子轨道表示式为______________________。
(2)Q、R元素形成的某四核分子中共有14个电子,该分子中R原子采取______ 杂化,该分子的立体构型为___________。
(3)X与Q形成的简单化合物的水溶液中存在多种氢键,任表示出其中两种_____________,_____________;
(4)RY可以和很多过渡金属形成配合物,如Fe(RY)5、Ni(RY)4,其中Fe(RY)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断Fe(RY)5晶体属
于______________(填晶体类型),与RY互为等电子体的离子有__________(任写一种)。
(5)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气休,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为_____________________________。
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如右图所示。该合金的化学式为________________;
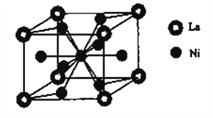
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com