


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、NaClO溶液中通入少量CO2气体的离子方程式:2ClO-+CO2+H2O=CO32-+2HClO |
| C、向0.1mol?L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、相同物质的量浓度的下列溶液,pH的大小关系是Na2CO3>NaHCO3>NaClO>CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
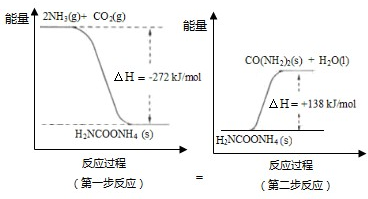
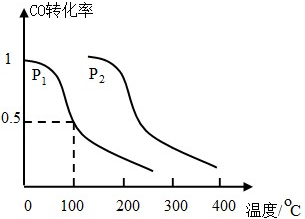
查看答案和解析>>
科目:高中化学 来源: 题型:
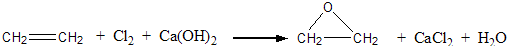
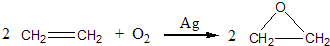
查看答案和解析>>
科目:高中化学 来源: 题型:
| ABn | 分子的立体构型 | 典型例子 |
| n=2 | ||
| n=3 | ||
| n=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
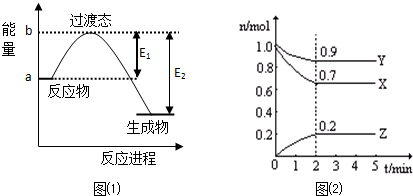
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火燃烧时,用泡沫灭火器灭火 |
| B、含硫酸的废液倒入水槽,用大量水冲入下水道 |
| C、氢氧化钠应该保存在带有橡胶塞的试剂瓶中 |
| D、稀释浓硫酸时,要慢慢地把适量水加进去,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水含有的分子数为NA |
| B、2NA个N2分子和2mol N2的质量都是28g |
| C、通常状况下,44g CO2气体所含氧原子数NA |
| D、1mol NO2中原子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com