
【题目】工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
科目:高中化学 来源: 题型:
【题目】保龄球与竹签可以用来制作有机分子球棍模型,保龄球代表有机分子中的原子,且保龄球个数和大小分别代表有机分子中的原子个数和类型;竹签代表有机分子中原子间结合的化学键,并以竹签的数目和类型代表化学键的数目和类型,下列关于用保龄球和竹签制作分子球棍模型的判断,正确的是( )
A. 甲烷的球棍模型需要用五个保龄球和五根竹签制作
B. 甲烷球棍模型中,较大的保龄球代表甲烷分子中的氢原子
C. 甲烷的球棍模型中,五个保龄球的球心不在同一平面上
D. 制作乙烯的模型时,需要用到六根完全相同的竹签
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:Na+、AlO2-、NO3—、Fe2+
B. 0.1 molL-1HCl溶液:Ba2+、K+、CH3COO-、NO3—
C. 0.1 molL-1 CO32-的溶液:Na+、Fe3+、NO![]() 、SCN-
、SCN-
D. Kw/c(H+)=0.1 molL-1的溶液:Na+、K+、SO32-、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈;____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____。
(3)用电子式表示次氯酸形成过程______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
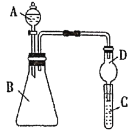
(1)仪器D的名称为_____,其作用为___。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,用离子方程式表示该尾气吸收原理______。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有____的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
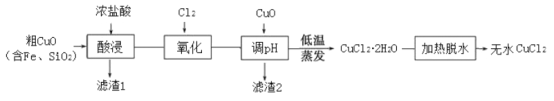
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式____________________________
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO3)2。
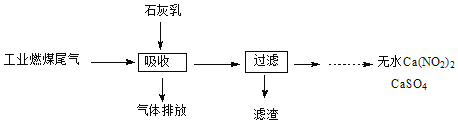
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为____________________________、 ______________________________
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为___________________________
③Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式___________________________
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
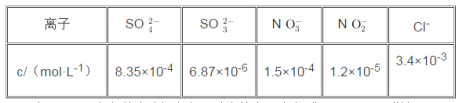
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_____________________________。增加压强,NO的转化率_______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“提高”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
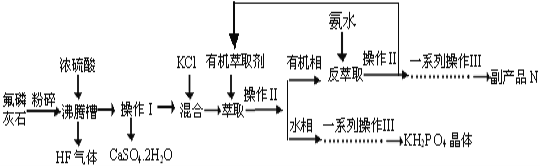
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
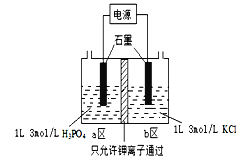
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、SCN-B.H+、Fe2+、SO42-、NO3-
C.Ca2+、Al3+、NO3-、Cl-D.K+、NH4+、CO32-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com