
【题目】化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列有关叙述正确的是( )
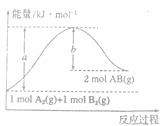
A.每生成2molAB(g)吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=+(a-b)kJ/mol
D.形成1molA-A键和1mo1B-B键,吸收akJ能量
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离
B.电解质越弱,则其溶液的导电能力就越差
C.在白色ZnS沉淀上滴![]() 溶液,沉淀变黑,说明相同条件下溶解度CuS比ZnS更小
溶液,沉淀变黑,说明相同条件下溶解度CuS比ZnS更小
D.加热NaR溶液时,溶液的pH变小,证明HR为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() ,少量
,少量![]() 和金属硫酸盐
和金属硫酸盐![]() 为原料,生产氧化铝并获得
为原料,生产氧化铝并获得![]() 的部分工艺流程如下:
的部分工艺流程如下:

![]() 粉碎高硫铝土矿石的目的是______。
粉碎高硫铝土矿石的目的是______。
![]() 焙烧时发生氧化还原反应:______
焙烧时发生氧化还原反应:______![]() ______
______![]() ______
______![]() ______
______![]() ,配平该方程式。
,配平该方程式。
![]() 碱浸时发生反应的化学方程式为______。
碱浸时发生反应的化学方程式为______。
![]() 过滤后向滤液中通入过量的
过滤后向滤液中通入过量的![]() 气体,反应的离子方程式为______。
气体,反应的离子方程式为______。
![]() “过滤”得到的滤渣中含有大量的
“过滤”得到的滤渣中含有大量的![]() 与
与![]() 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成![]() 和
和![]() ,理论上完全反应消耗的
,理论上完全反应消耗的![]() :
:![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
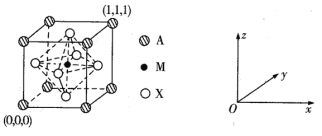
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:
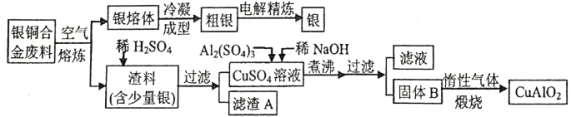
注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列操作、现象,所得结论正确的是![]()
选项 | 操作 | 现象 | 结论 |
A | 向25mL冷水和沸水中分别滴入5滴 | 前者为黄色. 后者为红褐色 | 温度升高, 程度增大 |
B | NaOH的乙醇溶液与溴乙烷共热,产生的气体通入 酸性高锰酸钾溶液中 | 溶液褪色 | 产生的气体为乙烯 |
C | 铜铝合金加入一定量稀硝酸中,有金属剩余,再加稀硫酸 | 剩余金属质量减小 | 铝与稀硫酸反应使 剩余金属质量减小 |
D | 盛有 | 气体变为无色 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物甲经氧化得到乙(C2H3O2Cl),而甲在NaOH水溶液中加热反应可得到丙,1mol丙和2mol乙反应得到一种含氯的酯(C6H8O4Cl2)。由此推断甲的结构简式为( )
A.ClCH2CH2OHB.
C.CH2ClCHOD.HOCH2CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com