
| n |
| V |
| 2.24L |
| 22.4L/mol |
| 0.2mol |
| 4.0mol/L |
| n |
| V |


科目:高中化学 来源: 题型:
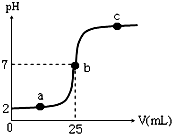 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
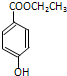 ).
).
查看答案和解析>>
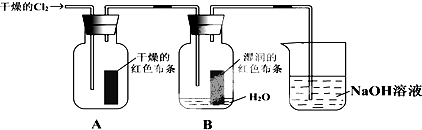
科目:高中化学 来源: 题型:
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
查看答案和解析>>
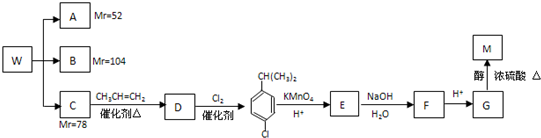
科目:高中化学 来源: 题型:
| 稀硫酸 |
| △ |
| 一定条件 |
| 试剂X |
| NaOH溶液 |
| △ |
| [O] |
| H2O |
| [O] |
| [O] |
| KMnO4 |
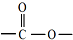 ,且无环状结构的同分异构体有
,且无环状结构的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
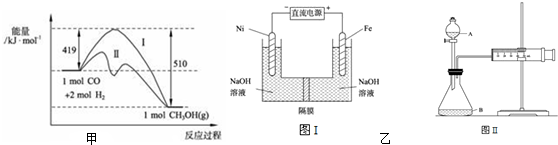
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
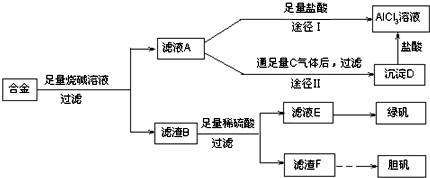
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com