
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是( )
A.Na2O2能分别与H2O、CO2反应,可用作供氧剂
B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂
C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净化
D.液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+
C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
用如图所示装置进行实验,下列叙述不正确的是 ( )
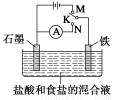
A.K与N连接时,铁被腐蚀
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增大
D.K与M连接时,石墨电极反应式:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是( )
A.Na+、Ba2+、NO3-、CO32-
B.Ba2+、K+、Cl-、NO3-
C.Mg2+、NH4+、SO42-、Cl-
D.Fe2+、Na+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:填空题
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若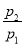 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下2.24 L H2O中,分子数为0.1 NA
B.将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA
C.常温常压下16 g O2和O3混合气体中,氧原子数为NA
D.7.8 g Na2O2与足量水反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:实验题
奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
________________________________________________________________________________________________________________________________________________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(3)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵然后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.0 mL,则该样品中N的含量为________。
[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题9金属及其化合物练习卷(解析版) 题型:填空题
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号 | ① | ② | ③ | ④ |
稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com