
| 8 |
| 3 |
| 12160g×52.5% |
| 152g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
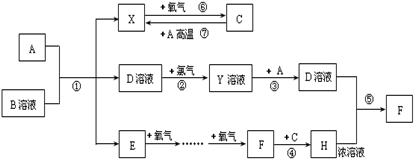
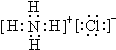
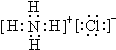
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 |
| I | 取一定质量的FeCO3固体置于坩埚中,高温燃烧至质量不再减轻,冷却至室温. |
| II | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| III | 向实验步骤II所得溶液中滴加KSCN溶液,溶液变红. |
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省高三11月联考化学试卷(解析版) 题型:填空题
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
|
实验步骤 |
实验操作 |
|
Ⅰ |
取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
|
Ⅱ |
取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
|
Ⅲ |
向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)写出实验步骤Ⅲ中发生反应的离子方程式__________________________________。
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是____________(填序号)。
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是____________。
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、________ (填试剂名称)和氨水;再_________(填操作名称),灼烧,即可得到Fe2O3。
(5)工业上用氧化还原滴定法测菱铁矿中FeCO3的质量分数,通过控制样品的质量,使滴定时消耗KMnO4溶液体积为c mL,对应菱铁矿中FeCO3的质量分数为c%,可以简化计算。某同学取含FeCO3 c%的菱铁矿a g,用足量稀硫酸溶解后,再用0.0 200 mol·L-1的酸性KMnO4溶液滴定(KMnO4被还原成Mn2+),最终消耗KMnO4溶液c mL。假定矿石中无其他还原性物质,则所取菱铁矿的质量a=__________g。(FeCO3的摩尔质量为116 g·mol-1)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省四校联考化学试卷(解析版) 题型:计算题
金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是 。
A.密闭容器中总压强不变
B.密闭容器中混合气体的平均摩尔质量不变
C.密闭容器中混合气体的密度不变
D.c(CO)= c(CO2)
E.Fe2O3的质量不再变化
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向 反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为 反应(填“吸热”或“放热”) 。
(3)已知:3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) △H=–47
kJ/mol
2Fe3O4(s)+CO2(g) △H=–47
kJ/mol
Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H=
+19 kJ/mol
3FeO(s)+CO2(g) △H=
+19 kJ/mol
FeO(s)+CO(g) Fe(s)+CO2(g) △H=–11 kJ/mol
Fe(s)+CO2(g) △H=–11 kJ/mol
则Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的△H=
。
2Fe(s)+3CO2(g)的△H=
。
(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
|
温度 |
250℃ ~ 600℃ ~ 1000℃ ~ 2000℃ |
|
主要成分 |
Fe2O3 Fe3O4 FeO Fe |
800℃时固体物质的主要成分为 ,该温度下若测得固体混合物中m(Fe)︰m(O)=105︰32,则Fe3O4被CO还原为FeO的百分率为 (设其它固体杂质中不含Fe、O元素)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com