
下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl-
C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:
Al3++2SO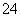 +2Ba2++4OH-===AlO
+2Ba2++4OH-===AlO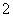 +2BaSO4↓+2H2O
+2BaSO4↓+2H2O
科目:高中化学 来源: 题型:
硅单质是从它的氧化物中提取出来的,主要的化学反应如下:
SiO2 + 2C Si+2CO↑
Si+2CO↑
石英砂 焦炭 粗硅
Si(粗)+2Cl2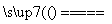 SiCl4
SiCl4
SiCl4+2H2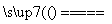 Si(纯)+4HCl
Si(纯)+4HCl
根据以上反应,回答下列问题:
(1)在制取粗硅的反应中,焦炭的作用是____________________________________。
(2)在由粗硅制取纯硅的反应中Cl2与Si的反应属于________(填四种基本反应类型);SiCl4与H2的反应属于________(填四种基本反应类型),H2的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应2C(固)+O2(气) 2CO(气)和2CO(气)+O2(气)
2CO(气)和2CO(气)+O2(气) 2CO2(气)都是放热反应。据此判断,下列说法中不正确的是(其他条件均相同)( )
2CO2(气)都是放热反应。据此判断,下列说法中不正确的是(其他条件均相同)( )
A.12 g C所具有的能量一定高于28 g CO所具有的能量
B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:
A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3)
B.结合H+的能力:Y>CO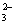 >X>HCO
>X>HCO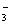
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO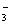 )>C(X)>c(OH)>c(H+)
)>C(X)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
把足量ZnS固体加入到0.001mol/L的CuSO4溶液中。试判断是否有CuS沉淀生成?已知 Ksp(ZnS)=1.6×10-23mol2•L-2 Ksp(CuS)=1.3×10-36mol2•L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
既能与盐酸反应,又能与NaOH溶液反应的是
①SiO2;②Al(OH)3;③(NH4)2CO3;④Na2CO3;⑤NaHSO3;⑥NaHSO4
A.②③⑤ B.①②③⑥ C.②③④⑤ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①③④⑤ B.①④ C.②③ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
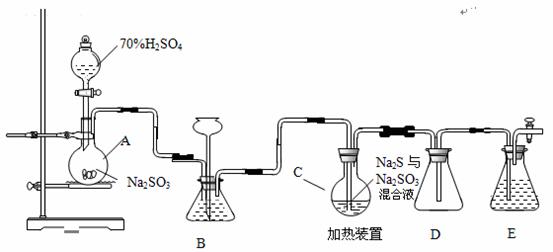
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)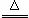 Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。
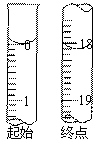 (6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质)。某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L¯1碘的标准溶液滴定。反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如下图,则产品的纯度为_________。经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O3•5H2O和其他杂质)。某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L¯1碘的标准溶液滴定。反应原理为:2S2O32-+I2=S4O62-+2I¯,滴定至终点时,滴定起始和终点的液面位置如下图,则产品的纯度为_________。经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差)
。
[M(Na2S2O3•5H2O)=248g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的离子方程式:
(1)铁粉加入CuSO4溶液中:
________________________________________________________________________,
(2)Cl2通入石灰水中:
________________________________________________________________________,
(3)漂白粉溶液与空气中CO2反应:
________________________________________________________________________,
(4)向沸水中滴加少量FeCl3溶液制备Fe(OH)3胶体:
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com