
A、 |
B、 |
| C、CH3CH2CH2CH2CH2OH |
| D、CH3CH2CH2OCH2CH3 |
| 88×68.2% |
| 12 |
| 88×13.6% |
| 1 |
| 88-12×5-1×12 |
| 16 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
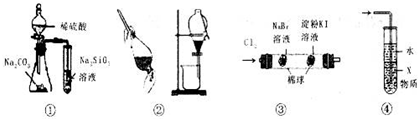
| A、图①所示实验,能比较硫、碳、硅三种元素的非金属性强弱 |
| B、装置②可用于从溴水中提取单质溴 |
| C、装置③中,左边棉花变为橙色,右边棉花变为蓝色,证明氧化性:Cl2>Br2>I2 |
| D、装置④中,X若为CCl4,可用吸收NH3或HCl,并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应开始时,石墨棒作阳极,银棒作阴极 |
| B、灵敏电流计的读数由小变大,再变小 |
| C、反应达化学平衡时,电流计读数最大 |
| D、反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
| C、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| D、NaHCO3溶液与NaOH溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室里需要480 mL 2.0 mol?L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作 |
| B、用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低 |
| C、蒸发硫酸铜溶液时蒸发皿放在石棉网上加热,并用坩埚钳夹取蒸发皿 |
| D、向氧氧化铁胶体中逐滴加入稀硫酸,先出现红褐色沉淀,继续滴加硫酸,沉淀溶解得到黄色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水和SO2使品红溶液褪色及SO2可使酸性高锰酸钾溶液褪色的原理不同 |
| B、向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失该原溶液一定含有SO42- |
| C、用KSCN溶液鉴别FeCl2溶液、FeCl3溶液 |
| D、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com