
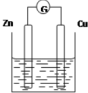
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:分析 (1)Zn、Cu、稀硫酸构成原电池,锌易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,电子从负极沿导线流向正极,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是铜片不纯,本身上构成了许多微小的原电池;
(3)如果把锌片换成石墨,该装置不能自发进行氧化还原反应,所以不能构成原电池;
解答 解:(1)①负极的电极反应式:Zn-2e-=Zn2+,故错误;
②H+向正极移动,故错误;
③电子从负极流向正极,所以电子流动方向Zn→Cu,故正确;
④在Cu处产生1.12L H2,状态不知,无法由体积求物质的量,故错误;故答案为:③;
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是铜片不纯,本身上构成了许多微小的原电池,故答案为:铜片不纯;
(3)如果把锌片换成石墨,该装置不能自发进行氧化还原反应,所以不能构成原电池,所以没有电流产生,故答案为:Cu和石墨都不与硫酸反应,不符合原电池形成条件.
点评 本题考查了原电池原理,明确原电池构成条件、正负极上发生的反应即可解答,知道电子流向、电解质溶液中阴阳离子流动方向,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 8.8 | 17.6 | 22.0 |
| 气体体积/L | 2.24 | 4.48 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟在自然界中常以CaF2的形式存在.
氟在自然界中常以CaF2的形式存在.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐提纯蒸发时,待水分完全蒸干后停止加热 | |
| B. | 过滤时,漏斗下口尖端紧贴烧杯内壁 | |
| C. | 蒸馏时,冷却水应从冷凝管上口进下口出 | |
| D. | 分液操作时,上层液体应从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 常温下,4g 14CH4含有NA个C-H共价键 | |
| C. | 25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA | |
| D. | 0.1 mol•L-1 Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L 1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol•L-1 | |
| B. | 物质的量是指物质所含微粒的数目 | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 冰水混合物既是纯净物又是化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com