
【题目】铜及其化合物在生活、生产中有广泛应用。
(1)常用胆矾溶液对游泳池中的水消毒,它的水溶液呈酸性,用离子方程式表示其原因:________________________________________________________________________________。
(2)在Cu(OH)2悬浊液中滴加氨水,蓝色沉定变成蓝色溶液。已知:Ksp[Cu(OH)2]=2.2×10-20,Cu2+(aq)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)K1=2.0×1013。则
[Cu(NH3)4]2+(aq)K1=2.0×1013。则
Cu(OH)2(s)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)K2=_____________。
[Cu(NH3)4]2+(aq)+2OH-(aq)K2=_____________。
(3)Cu(OH)2溶于浓烧碱溶液生成Na2CuO2,在Na2CuO2溶液中滴加CuCl2溶液,可能观察到的现象是______________________________________________________________________________。
(4)纳米级氧化亚铜(Cu2O)常作催化剂。工业上可用电解法制备,装置如图所示。
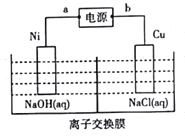
①a极名称是_________________;阳极的反应式为___________________。
②若电解过程中有1mol离子通过交换膜,则制备Cu2O的质量为_____________g。
【答案】 Cu2++2H2O![]() Cu(OH)2+2H+ 4.4×10-7 产生蓝色沉淀 负极 2Cu-2e-+H2O=Cu2O+2H+或2Cu-2e-+2OH-=Cu2O+H2O 72
Cu(OH)2+2H+ 4.4×10-7 产生蓝色沉淀 负极 2Cu-2e-+H2O=Cu2O+2H+或2Cu-2e-+2OH-=Cu2O+H2O 72
【解析】(1)常用胆矾溶液对游泳池中的水消毒,它的水溶液因铜离子水解而呈酸性,离子方程式为Cu2++2H2O![]() Cu(OH)2+2H+。
Cu(OH)2+2H+。
(2)氢氧化铜的沉淀溶解平衡可表示为Cu(OH)2![]() Cu2++2OH-,由Ksp[Cu(OH)2]=2.2×10-20以及Cu2+(aq)+4NH3(aq)
Cu2++2OH-,由Ksp[Cu(OH)2]=2.2×10-20以及Cu2+(aq)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)的K1=2.0×1013可知,Cu(OH)2(s)+4NH3(aq)
[Cu(NH3)4]2+(aq)的K1=2.0×1013可知,Cu(OH)2(s)+4NH3(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)的 K2= Ksp[Cu(OH)2]
[Cu(NH3)4]2+(aq)+2OH-(aq)的 K2= Ksp[Cu(OH)2] ![]() K1=2.2×10-20
K1=2.2×10-20![]() 2.0×1013=4.4×10-7。
2.0×1013=4.4×10-7。
(3)在Na2CuO2溶液中滴加CuCl2溶液,两者可以发生互促水解反应(前者水解显碱性、后者水解显酸性,因而可以互相促进)生成氢氧化铜沉淀,所以可能观察到的现象是产生蓝色沉淀。
(4)①由题意知,铜被氧化生成纳米级氧化亚铜,则铜电极为阳极,所以b为电源正极,a为电源负极;阳极的反应式为2Cu-2e-+H2O=Cu2O+2H+或2Cu-2e-+2OH-=Cu2O+H2O。
②由阳极的电极反应可知,电路中通过2mol电子时,同时有2mol离子通过离子交换膜,可以生成1molCu2O。因此,电解过程中有1mol离子通过交换膜时,可以制备0.5mol Cu2O,其质量为72g。


科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.氢气的摩尔质量是2g/mol
B.标准状态下22.4L水的物质的量是1mol
C.常温常压下氢气的摩尔体积是22.4L/mol
D.常温常压下16gO2的物质的量是1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和对应的离子方程式都正确的是( )
选项 | 实验操作 | 离子方程式 |
A | 向溴化亚铁溶液中滴加氯水,证明还原性:Fe2+>Br- | Cl2+2Br-=Br2+2Cl- |
B | 用澄清石灰水鉴别K2SO3溶液和KHSO3溶液 | Ca2++SO32-=CaSO3↓ |
C | 用饱和Na2CO3溶液浸泡试管中的硫酸钙 | CaSO4+CO32- |
D | 向Al2(SO4)3溶液中滴加氨水制备氢氧化铝 | Al3++3OH-=Al(OH)3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断 Na2SeO3的作用是( )
A.作还原剂B.作氧化剂C.既作氧化剂又作还原剂D.既不作氧化剂又不作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰) Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列关于该有机物的说法正确的是
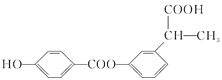
A. 1 mol 该有机物含有 6 mol 碳碳双键
B. 1 mol 该有机物完全燃烧可生成9 mol H2O
C. 1 mol 该有机物可电离生成2 mol H+
D. 1 mol 该有机物最多可与6 mol H2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。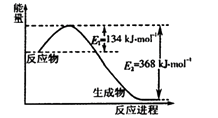
(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2 , 在一定条件下发生如下反应。N2(g)+3H2(g) ![]() 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) ![]() 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com