
下列设备工作时,将化学能转化为热能的是( )
| A | B | C | D |
|
|
|
|
|
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
科目:高中化学 来源: 题型:
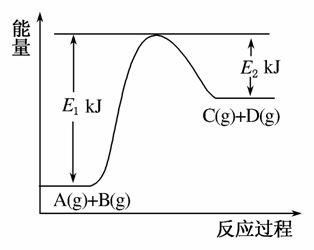
)已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z有如图所示的转化关系,则X和Y可能是( )

①Si和SiO2 ②AlCl3和Al(OH)3
③CuO和CuSO4 ④Fe和FeCl2
A.①②③④ B.①②
C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式__________________________________。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是______________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?__________________________________ __________________________________。
(3)合成氨工业中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为12时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:2Fe2O3+C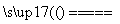 4FeO+CO2↑。
4FeO+CO2↑。
实验教师提供了12 g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
(1)下面是利用氮气的一种途径
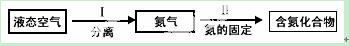
①步骤I中主要利用N2与液态空气中其它成分的________(填性质)不同。
②最新研究发现在碱性溶液中通过电解反应2N2+6H2O 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
(2)氨气可以用于侯氏制碱法,其流程如下图所示:
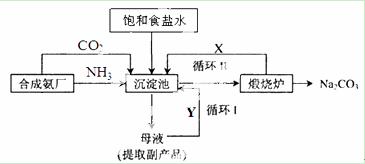
①循环I、II中循环利用的物质X是_________ ,Y是__________。(填化学式)
②向沉淀池中通入气体时,需要先通入NH3,再通入CO2,其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
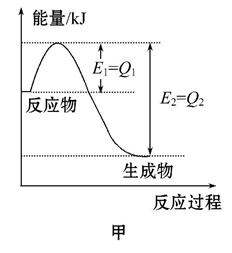
Ⅰ.图甲是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):_____________。
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=____________;
4NH3(g)+3O2(g) ΔH=____________;
(2)饮用水中的N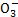 主要来自于N
主要来自于N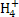 。已知在微生物的作用下,N
。已知在微生物的作用下,N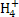 经过两步反应被氧化成N
经过两步反应被氧化成N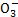 。两步反应的能量变化示意图如图乙:
。两步反应的能量变化示意图如图乙:
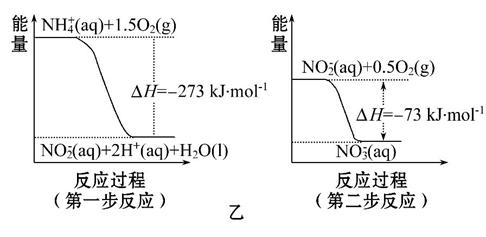
1 mol N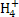 全部被氧化成N
全部被氧化成N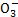 的热化学方程式为___________________________。
的热化学方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com