
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂 | |
| D. | 氢氧燃料电池工作时氢气在正极被氧化 |
分析 A、氢氧燃料电池是将化学能转变为电能;
B、氢氧电池的能量转化率不是100%;
C、燃料电池的燃料和氧化剂从外部供给;
D、负极发生氧化反应.
解答 解:A、氢氧燃料电池也属于原电池,是将化学能转变为电能的装置,故A错误;
B、氢氧燃料电池放电时,只有一部分能量转化为电能,所以能量转化率不是100%,故B错误;
C、燃料电池的电极本身不包含活性物质,如氢氧燃料电池,燃料电池的燃料和氧化剂从外部供给,而干电池或蓄电池不是外部提供,故C正确;
D、负极发生氧化反应,所以氢氧燃料电池工作时氢气在负极被氧化,故D错误;
故选C.
点评 本题考查了氢氧燃料电池中的有关知识,注意燃料电池也是原电池,原理相同,不同的是投料方式,比较容易.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:实验题
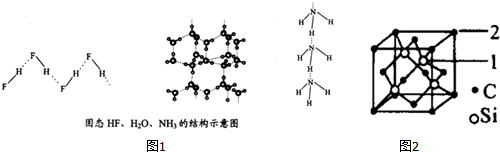
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N-H键键能的含义是把1molNH3中的共价键全部拆开所吸收的能量 | |
| B. | ClO-的空间构型为平面三角形 | |
| C. | 卤素单质从F2到I2,在常温常压下的聚集状态由气态、液态到固态的原因是原子半径逐渐增大 | |
| D. | 熔点由高到低的顺序为:金刚石>MgO>NaCl>CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径和离子半径均减小 | |
| B. | 金属性减弱,非金属性增强 | |
| C. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| D. | 单质的熔点降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com