
分析 (1)化合价降低的元素所在的反应物是氧化剂,还原剂对应的产物是氧化产物;
(2)根据反应转移的电子数、消耗和生成的各个物质的量的知识来计算;
(3)根据物质的量浓度和密度之间的计算公式来计算.
解答 解:(1)反应中锰元素化合价降低,锰元素所在的反应物KMnO4是氧化剂,氯化氢是还原剂,则氯气为氧化产物,故答案为:KMnO4;Cl2;
(2)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:$\frac{10}{16}$,15.8g (即0.1mol)KMnO4完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol,
故答案为:5.6L;0.5;
(3)根据物质的量浓度和密度之间的计算公式c=$\frac{1000ρω}{M}$=$\frac{1000×1.2g/mL×36.5%}{36.5}$=12mol/L,故答案为:12mol/L.
点评 本题氧化还原反应的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,解答本题注意把握元素化合价的变化,根据方程式计算.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
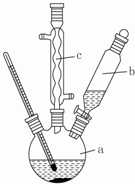 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: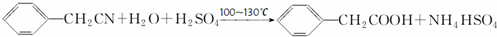 ;
;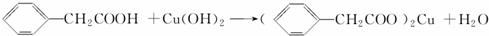
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com