
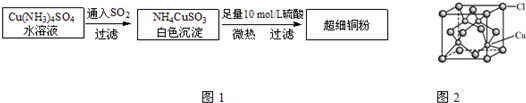
| ||
| ||
| 6+2 |
| 2 |
| 6+2 |
| 2 |
| ||


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:阅读理解
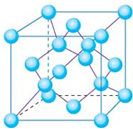 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.| 2880 |
| NA |
| 2880 |
| NA |


| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
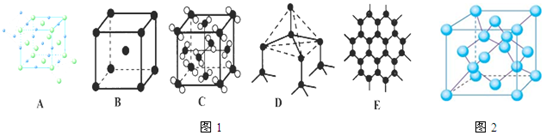
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都七中高二(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省雅安中学高二(上)月考化学试卷(10月份)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com