
分析 (1)根据n=$\frac{v}{{v}_{m}}$、m=nM、ρ=$\frac{m}{V}$计算混合气体的密度;
(2)假设取该气体1mol,根据m=nM计算1mol该气体的质量,根据V=$\frac{m}{ρ}$计算其体积,根据气体摩尔体积Vm=$\frac{V}{n}$来计算;
(3)摩尔质量与相对分子质量的数值相等,该气体在标准状况下的密度为1.25g•L-1,根据M=ρVm计算A的相对分子质量.
解答 解:(1)在标准状况下,22.4L H2的物质的量为n=$\frac{v}{{v}_{m}}$=$\frac{22.4L}{22.4L/mol}$=1mol,其质量为:m=nM=1mol×2g/mol=2g,11.2L O2的物质的量为n=$\frac{v}{{v}_{m}}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,其质量为:m=nM=0.5mol×32g/mol=16g,混合气体的密度为ρ=$\frac{m}{V}$=$\frac{16g+2g}{33.6L}$≈0.5357g/L,
故答案为:0.5357g/L;
(2)假设取该气体1mol,m=nM=1mol×29.3g•mol-1=29.3g,其体积为:V=$\frac{m}{ρ}$=$\frac{29.3g}{1.285g/L}$≈22.802g/L,
故答案为:22.802g/L;
(3)在标准状况下,Vm=22.4L/mol,该气体在标准状况下的密度为1.25g•L-1,M=ρVm=1.25g•L-1×22.4L/mol=28g/mol,摩尔质量与相对分子质量的数值相等,则A的相对分子质量为28,
故答案为:28.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 需要使用托盘天平称量Na2CO3•10H2O晶体2.86g | |
| B. | 将称量好的Na2CO3•10H2O晶体放入烧杯中,加入100mL蒸馏水,搅拌、溶解 | |
| C. | 转移溶液时应使用玻璃棒引流,且玻璃棒末端应靠在容量瓶刻度线下方 | |
| D. | 定容时,俯视刻度线会使所配制溶液的物质的量浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
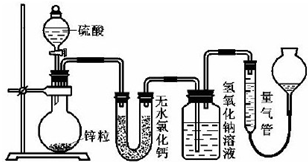
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入淀粉碘化钾溶液中,溶液变蓝,氧化性:Cl2>I2 | |
| B. | 久置的氯水最终变为稀盐酸 | |
| C. | NaClO溶液的漂白原理与Na202相同,与SO2不同 | |
| D. | 无色溶液C中加入AgN03溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则无色溶液C中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
| A. | 碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-═NO3-+Cl- | |
| B. | 向冷的NaNO2溶液中通入CO2可得到HNO2 | |
| C. | 向冷的NaNO2溶液中加入稀硫酸可得到HNO2 | |
| D. | 向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
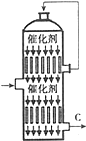 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| B. | b曲线是加入催化剂时的能量变化曲线 | |
| C. | 该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ•mol-1 | |
| D. | 在温度、体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,则Q1<92 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com