
 碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:分析 (1)①依据盖斯定律和热化学方程式计算得到所需的热化学方程式,利用热化学方程式的加减消去不需要的物质,注意加减时焓变随之变化;
②据溶洞的形成是化学反应在自然条件下进行的,故活化能较高据此进行分析;
(2)①氨气,二氧化然,水和氯化钠反应生成碳酸氢钠和氯化铵,据此书写离子方程式;NaHCO3溶液存在水的电离平衡、弱酸根离子的水解平衡、电离平衡;根据K=$\frac{c(HC{{{O}_{3}}^{-}}_{\;})×c({H}^{+})}{c({H}_{2}C{O}_{3})}$计算;
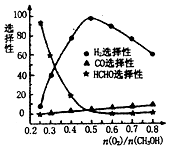
②根据恒容条件下压强之比等于物质的量之比求出甲醇的转化量,然后再求转化率;根据图象可知,当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛;在制备H2时最好控制n(O2)/n(CH3OH)=0.5时气生成最多.
解答 解:(1)①已知热化学方程式:2CO2(g)+2H2O(l)+2C5H10O4(s)═4(C3H6O3)+(s)+O2(g)+4e-△H═+1360kJ•mol-1 ①
12(C3H6O3)(s)+12e-═C6H12O6(S,葡萄糖)+6C5H10O4(s)+3O2(g)△H=-1200kJ•mol-1②
根据盖斯定律,将①×3+②可得:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1,
故答案为:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1;
②溶洞形成过程极为缓慢的原因是溶洞形成过程的化学反应在自然条件下活化能较高,
故答案为:溶洞形成过程的化学反应在自然条件下活化能较高;
(2)①氨气,二氧化然,水和氯化钠反应生成碳酸氢钠和氯化铵,故离子方程式为NH3+CO2+H2O+Na+=NaHCO3↓+NH4+;NaHCO3溶液中存在H2O?H++OH-、HCO3-+H2O?+H2CO3+OH-、HCO3-+H2O?H3O++CO32-,由上述数据得,NaHCO3溶液显碱性的原因为NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;
溶液为中性,则c(H+)=10-7mol/L,则c(H+)=10-7mol/L,K=$\frac{c(HC{{{O}_{3}}^{-}}_{\;})×c({H}^{+})}{c({H}_{2}C{O}_{3})}$=4.4×10-7,则$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=4.4,
故答案为:NH3+CO2+H2O+Na+=NaHCO3↓+NH4+;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;4.4;
②反应为CH3OH(g)?CO(g)+2H2(g)
n起始 0.6 0 0
n转化 x x 2x
n平衡 0.6-x x 2x
$\frac{{P}_{2}}{{P}_{1}}$=2.2
x=0.36mol
则该条件下CH3OH的平衡转化率为$\frac{0.36}{0.6}$×100%=60%,
根据图象可知,当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH3OH+O2?2HCHO+2H2O;依据图象分析,在制备H2时最好控制n(O2)/n(CH3OH)=0.5时氢气生成最多,
故答案为:60%;2CH3OH+O2?2HCHO+2H2O;0.5.
点评 本题考查了热化学方程式书写,离子方程式的书写、转化率、反应速率等问题,要注意图象正确分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
 其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )
其他条件不变时,改变密闭容器中某一条件,对反应A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所 示的曲线(T 表示温度,n 表示物质的量).下列判断正确的是( )| A. | 若 T1>T2,则正反应是吸热反应 | |
| B. | 达到平衡时,A2转化率:b>a>c | |
| C. | 在 T2和起始 n(A2)不变时达到平衡,n(AB3)大小为:c>b>a | |
| D. | 若 T2>T1,达到平衡时 b、d 两点的反应速率为:d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ•mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
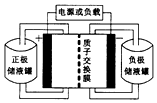 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的正极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-═BrCl2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
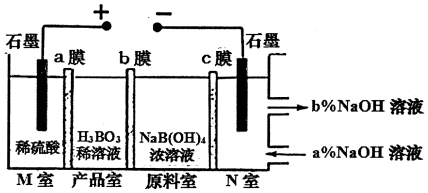
| A. | M室发生的电极反应式:2H2O-4e-═O2↑+4H+ | |
| B. | N室:a%<b% | |
| C. | 产品室发生的反应是:B(OH)4-+H+?H3BO3+H2O | |
| D. | 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: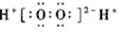 | B. | CCl4的电子式: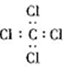 | ||
| C. | ${\;}_{\;}^{18}$O的原子结构示意图: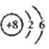 | D. | MgCl2的电子式: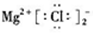 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
| A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
| B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
| C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
| D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com