


科目:高中化学 来源: 题型:
| A、用25mL碱式滴定管量取18.0mL KMnO4溶液 |
| B、在含有FeC12杂质的FeC13溶液中通入足量C12后,充分加热,即可得到纯净的FeC13溶液 |
| C、使用湿润的pH试纸测定气体的酸碱性 |
| D、为减小中和滴定误差,锥形必须用待测液润洗后才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )| a极板 | b极板 | X电极 | Z溶液 | |
| A | 银 | 铁 | 正极 | AgNO3 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A、A |
| B、B |
| C、C |
| D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
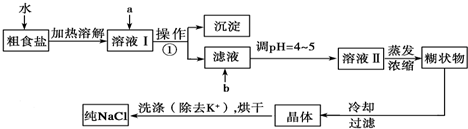
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体甲可能为CO2 或者SO2 |
| B、沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C、该溶液中肯定存在的离子有K+、AlO2-、SO32-、SO42-、NO2- |
| D、只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
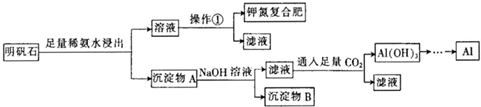
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com