
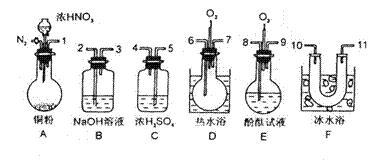 |
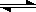 N2O4-Q,所以应选择热水浴的装置D,为防止污染,实验最后需有尾气处理装置。另外,为防止NO2与H2O反应生成NO,需要在NO2液化前将H2O(气)除去。本题只能先除去水再除去NO2才能证明NO的存在,命题者通过严密的构思,重视实验设计的能力训练,达到了对实验能力考查的目的,也体现了科学思维素质的培养。解题者只有克服思维定势、运用科学思维方法,方能消除错误隐患。
N2O4-Q,所以应选择热水浴的装置D,为防止污染,实验最后需有尾气处理装置。另外,为防止NO2与H2O反应生成NO,需要在NO2液化前将H2O(气)除去。本题只能先除去水再除去NO2才能证明NO的存在,命题者通过严密的构思,重视实验设计的能力训练,达到了对实验能力考查的目的,也体现了科学思维素质的培养。解题者只有克服思维定势、运用科学思维方法,方能消除错误隐患。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题






 :
:查看答案和解析>>
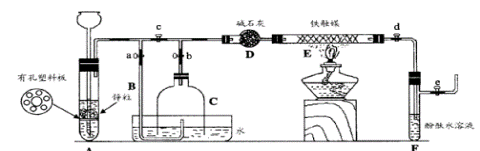
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
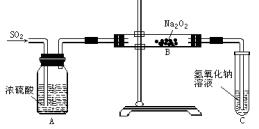
科目:高中化学 来源:不详 题型:实验题
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所消耗的铜的质量相等 |
| B.所消耗的硝酸的量:①>②>③ |
| C.对环境造成的危害,③最小 |
| D.制取硝酸铜的最佳方案是① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 44.6 | 略 |
| S2Cl2 | -77 | 137 | S2Cl2、遇水生成HCl、SO2、S且温度过高容易分解(300度以上完全分解) |
| SCl2 | -121 | 59.6(分解) |
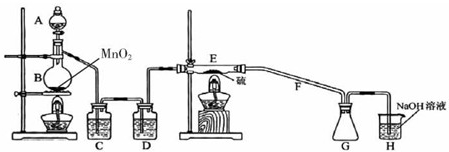
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a∶b | B.a∶2b | C.a∶(a+2b) | D.a∶2(a+b) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com