


科目:高中化学 来源: 题型:
| A、110g |
| B、110g/mol |
| C、55g/mol |
| D、55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 水煤气 | 大理石 | 苛性钠 | 醋酸 | 二氧化碳 |
| B | 胆矾 | 空气 | 硫酸钠 | 一水合氨 | 石墨 |
| C | 生石灰 | 水煤气 | 盐酸 | 碳酸 | 铜 |
| D | 烧碱 | 汽油 | 硫酸钡 | 水 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②中无色气体中有NO,可能含CO2 |
| B、③中沉淀有BaSO4,可能含BaCO3 |
| C、肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是 Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+、Cl- |
| D、②中红棕色气体通入水中发生反应的离子方程式为:3NO2+H2O=H++NO3-+2NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个甘氨酸分子中存在10对共用电子 |
| B、PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C、维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
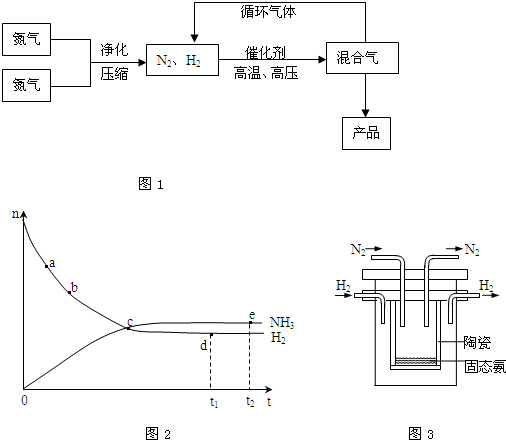
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
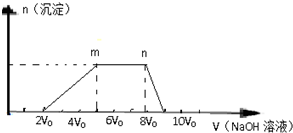 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com