
【题目】下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物
B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物
C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJmol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量
D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
【答案】B
【解析】
A. 反应物的总能量大于生成物的总能量为放热反应;
B. 反应物的总能量小于生成物的总能量为吸热反应;
C. 该反应为吸热反应;
D. 该反应为可逆反应。
A.当反应物总能量<生成物总能量,则反应是吸热反应,但该反应ΔH<0,A项错误;
B.当反应物总能量<生成物总能量,则反应是吸热反应,该反应ΔH>0,B项正确;
C.根据热化学方程式2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJ·mol-1可知HCl分解是吸热反应,C项错误;
D.反应N2(g)+3H2(g)![]() 2NH3(g)是可逆反应,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g)小于1.0mol,放热19.3kJ,则热化学方程式应为N2(g)+3H2(g)
2NH3(g)是可逆反应,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g)小于1.0mol,放热19.3kJ,则热化学方程式应为N2(g)+3H2(g)![]() 2NH3(g) ΔH<-38.6kJ·mol-1,D项错误;
2NH3(g) ΔH<-38.6kJ·mol-1,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
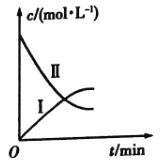
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素虽然种类不多,但是在自然界中的丰度却很大,请回答下列问题:
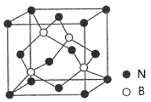
(1)BN(氮化硼,晶胞结构如图)和CO2中的化学键均为共价键,BN的熔点高且硬度大,CO2的晶体干冰却松软且极易升华。由此可以判断:BN可能是______晶体,CO2可能是______晶体,BN 晶体中B原子的杂化轨道类型为______,干冰中C原子的杂化轨道类型为______
(2)分子极性:OF2______H2O,键角:OF2______H2O(填“>””或者“<”)
(3)金刚石和石墨都是碳元素的单质,但石墨晶体熔点比金刚石______,原因是______
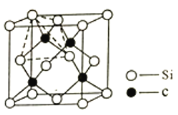
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构。在SiC结构中,每个C原子周围距离相等且最近的C原子数目为______,假设C-Si键长为acm,则晶胞密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可通过实验来验证淀粉水解生成还原性糖,其实验包括下列一些操作过程,这些操作过程的正确排列顺序是
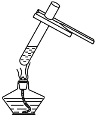
①取少量淀粉加水制成溶液
②加热煮沸
③加入碱液,中和并呈碱性
④加入新制的Cu(OH)2悬浊液
⑤加入几滴稀H2SO4
⑥再加热
A.①②⑤⑥④③ B.①⑤②③④⑥
C.①⑤②④⑥③ D.①⑥④⑤③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到实验目的的是( )
A. 用加热的方法除去碳酸钠固体中的碳酸氢钠
B. 加热蒸干溶液,可以得到CuCl2晶体
C. 放在流动的蒸馏水中可除去半透膜中蛋白质溶液里混有的(NH4)2SO4
D. 鉴别NaBr和KI溶液,可分别加新制氯水后,用CCl4萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 。采取下列措施能加快反应速率的是( )
。采取下列措施能加快反应速率的是( )
①升温 ②恒容下通入惰性气体 ③增加![]() 的浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体
的浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体
A.①②⑤B.①③⑤C.②④⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为干冰的晶体结构示意图。
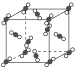
通过观察分析,每个CO2分子周围紧邻等距离的CO2分子有__个。将CO2分子视作质点,设晶胞边长为apm,则紧邻的两个CO2分子的距离为__pm。
(2)在冰晶体中,水分子之间的主要作用力是__,还有__,由于该主要作用力与共价键一样具有__性,故1个水分子周围只有__个紧邻的水分子,这些水分子位于__的顶点。这种排列方式使冰晶体中水分子的空间利用率__(填“较高”或“较低”),故冰的密度比水的密度要__(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )

A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图叙述正确的是![]()
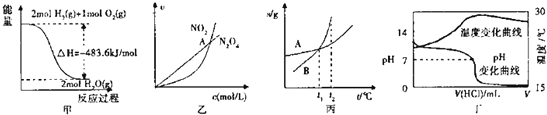
A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,
发生反应过程中的能量变化,![]() 的燃烧热为
的燃烧热为![]()
B.乙表示恒温恒容条件下反应![]() 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
D.丁表示室温下,将![]() 盐酸滴入
盐酸滴入![]()
![]() 氨水中,溶液pH和温度随加入盐酸体积变化曲线
氨水中,溶液pH和温度随加入盐酸体积变化曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com