
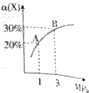
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
分析 A、由图得出:A、B两点,X的平衡转化率(α)不同;
B、增大压强平衡向体积减小的方向移动;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动;
D、可逆反应反应物不能完全转化,结合热化学方程式的含义解答.
解答 解:A、图中A、B两点,X的平衡转化率(α)不同,两者为不相同的平衡体系,故A错误;
B、增大压强平衡向体积减小的方向移动,即向正反应移动,X的转化率提高,故B正确;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动,故C错误;
D、热化学方程式X(g)+3Y(g)?2Z(g)△H=-92.4kJ/mol表示1molX(g)和3molY(g)完全反应生成2molZ(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0molX、3.0molY,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故D错误,故选B.
点评 本题主要考查化学平衡图象、反应热计算、影响化学平衡与化学反应速率的因素等,难度中等,注意D中热化学方程式的意义.


科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Na+、K+、Cl-、CO32- | |
| B. | 淀粉溶液中:K+、NH4+、SO42-、I- | |
| C. | Na2SiO3溶液中:Cl-、I-、K+、CO2 | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 周期表里,元素所在的周期序数等于原子核外最外层电子数 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3molClO-参加反应时,则有1molN2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5molClO-参加反应时,则有1molN2生成 | |
| D. | 若生成2.24LN2,则转移电子0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | He | -268.8 | (a) | -249.5 | Ar | -185.8 | Kr | -151.7 |
| 第二组 | F2 | -187.0 | Cl2 | -33.6 | (b) | 58.7 | I2 | 184.0 |
| 第三组 | (c) | 19.4 | HCl | -84.0 | HBr | -67.0 | HI | -35.3 |
| 第四组 | H2O | 100.0 | H2S | -60.2 | (d) | -42.0 | H2Te | -1.8 |
| A. | abc的化学式分别为Ne2、Br2、HF | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr<d | |
| C. | 第三组物质溶于水后,溶液的酸性c最强 | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com