
| A. | 不确定 | B. | 变小 | C. | 不变 | D. | 变大 |
分析 可逆反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)中,当化学平衡逆向移动时,混合气体的质量是增加的,混合气体的物质的量是增加的,根据体系气体的平均分子量等于质量和物质的量的比值来回答.
解答 解:可逆反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)中,当化学平衡逆向移动时,混合气体的质量是增加的,混合气体的物质的量是增加的,体系气体的平均分子量等于混合气体总质量和总物质的量的比值,两者变化趋势一样,所以结果无法判断,故选A.
点评 本题考查学生化学平衡一定原理的应用以及有关物质的量的计算知识,注意知识的归纳和梳理是解题的关键,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 | |
| B. | 乙烷(乙烯),催化条件下通入H2 | |
| C. | 乙酸(乙醛),加入新制氢氧化铜,蒸馏 | |
| D. | 乙醛(乙酸),加入氢氧化钠溶液洗涤,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制取氨气并完成喷泉实验
制取氨气并完成喷泉实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
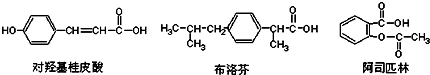
| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2) | |
| B. | 新制氯水使红色布条褪色(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com