
| A. | 元素的非金属性:c>b | |
| B. | a与b只能形成化合物ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | c与d形成的化合物能促进水的电离 |
分析 原子序数依次增大的元素a、b、c、d,它们的原子核外L层电子数分别为5、6、8、8,所以a、b分别为:N、O,c+的电子层结构与Ne的电子层结构相同,则c为Na元素;d-比c+多一个电子层,则d为Cl元素,据此结合元素周期律知识进行解答.
解答 解:A、元素的非金属性:O>Na,故A错误;
B、a、b分别为:N、O,氮的氧化物有六种,故B错误;
C、钠与氮、氧、氯能形成氮化钠、氧化钠、氯化钠等三种离子化合物,故C正确;
D、氯化钠是强酸强碱盐对水的电离无影响,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,推断元素是解题关键,侧重对元素周期律的考查,试题培养了学生的分析、理解能力及逻辑推理能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:N2+3H2 2NH3 △H <0,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
2NH3 △H <0,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
(1)平衡不发生移动
(2)平衡沿着正反应方向移动
(3)平衡沿着逆反应方向移动
(4)NH3的质量分数增加
(5)正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)(5)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
关于下图所示装置的判断,叙述正确的是( )
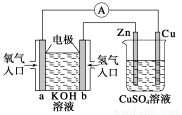
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
下列关于铜电极的叙述不正确的是( )
A.铜锌原电池中铜是正极 B.用电解法精炼铜时粗铜作阳极
C.在镀件上镀铜时可用铜作阳极 D.电解稀H2SO4制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 需要加热才能发生的化学反应,它可能是吸热反应也可能是放热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H<0 | |
| D. | △H的大小与热化学方程式的计量系数无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢 氨气 甲烷 铜 | |
| B. | H2SO4 HF 乙醇 氯化钠溶液 | |
| C. | 氢氧化钡 氢氧化钙 二氧化碳 氨水 | |
| D. | 氯化氢 食醋 葡萄糖 银 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
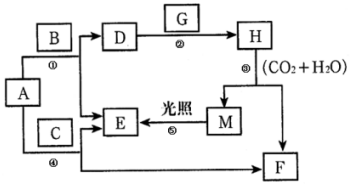 现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图,其他与题无关的生成物均已略去.请回答下列问题:
现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图,其他与题无关的生成物均已略去.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com