
【题目】常温下,下列溶液中各组离子一定能大量共存的是( )
A.加入铝粉有氢气生成的溶液中:Mg2+ , Cl- , NO3- , K+
B.常温下,c(H+) =0.1 mol/L的溶液中:Na+ , AlO2-、S2-、 SO32-
C.含有0.1 mol/LHCO3-的溶液:Na+ , Fe3+ , NO3- , SCN-
D.![]() =0.1 mol/L的溶液:Na+ , K+ , CO32- , NO3-
=0.1 mol/L的溶液:Na+ , K+ , CO32- , NO3-
【答案】D
【解析】A、加入铝粉有氢气生成的溶液显酸性或碱性,在碱性溶液中Mg2+不能大量存在,在酸性溶液中含有NO3-时,不放出氢气,A不符合题意;
B、常温下,在c(H+) =0.1 mol/L的溶液中AlO2-与酸反应生成沉淀、S2-、SO32-也能在酸性条件下分数氧化还原反应,不能大量共存,B不符合题意;
C、HCO3-与Fe3+发生双水解反应生成二氧化碳和氢氧化铁沉淀,不能大量共存,C不符合题意;
D、 ![]() =0.1 mol/L的溶液显碱性,在碱性溶液中,Na+ , K+ , CO32- , NO3-离子间不发生反应,能够大量共存,D符合题意;
=0.1 mol/L的溶液显碱性,在碱性溶液中,Na+ , K+ , CO32- , NO3-离子间不发生反应,能够大量共存,D符合题意;
故答案为:DA.能与铝反应生成氢气的溶液可能为酸性或碱性;
B.溶液中的AlO2-、S2-、 SO32-均能与H+发生反应;
C.溶液中Fe3+与SCN-不共存;
D.结合水的离子积计算溶液中c(H+);


科目:高中化学 来源: 题型:
【题目】下列各组离子中,在水溶液中能大量共存,且无色透明的是
A.Na+、Ba2+、NO3-、CO32-B.Cu2+、HCO3-、C1-、K+
C.Na+、K+、HCO3-、SO42-D.OH-、Cl-、Na+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊方法把固体物质加工到纳米级(1nm—100nm)的超细粉末粒子,然后制得纳米材料。下列分散质粒子直径具有与此相同数量级的是( )
A.淀粉溶液B.泥水C.酒精D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: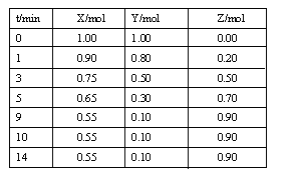
(2)体系中发生反应的化学方程式是;
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率;
(4)该反应达到平衡时反应物X的转化率α等于;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如下图所示)。则曲线①、②、③所对应的实验条件改变分别是:① ②③。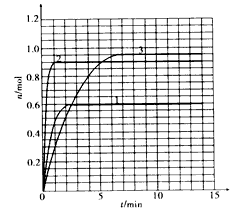
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是

A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CH2=CH2+ H2→CH3-CH3 , 有关化学键的键能如下: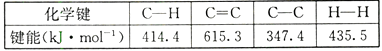
则该反应的反应热△H为( )
A.+288.8kJ/mo1
B.-703.4 kJ/mo1
C.+125.4kJ/mo1
D.-125.4 kJ/mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示。下列说法不合理的是
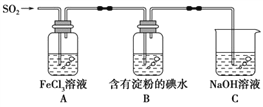
A. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
B. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
C. 装置C的作用是吸收SO2尾气,防止污染空气
D. 为了验证A中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:①硫酸②醋酸③氢氧化钠④氯化铵,请回答下列问题:
(1)①②③④四种溶液中促进水的电离的物质是(填序号)。
(2)①②③④四种溶液中pH由大到小的顺序是(填序号)。
(3)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是。
(4)25℃时,将pH=13的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=12,则a:b=。
(5)将a mol/L的氨水溶液与①等体积混合后,溶液呈中性,则氨水的电离平衡常数Kb=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。
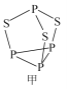

①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH3<NH3,其原因是____________________;沸点:PH3<AsH3<SbH3,其原因是_____________________________________________________。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_________________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______________。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_____________________________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com