
分析 (1)①根据c(H+)=$\frac{{K}_{w}}{C(O{H}^{-})}$,pH=-lgc(H+)计算;
②根据混合溶液中c(OH-)=$\frac{c(KOH)V(KOH)-c(H+)V({H}_{2}S{O}_{4})×2}{V(NaOH)+V({H}_{2}S{O}_{4})}$,c(H+)=$\frac{{K}_{w}}{C(O{H}^{-})}$,pH=-lgc(H+)计算;
(2)①该溶液可能为中性、酸性、碱性溶液,但溶液中一定满足电荷守恒,根据电荷守恒进行判断;
②已知0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后,得到的是同浓度的CH3COOH和CH3COONa溶液,溶液呈酸性说明醋酸电离大于醋酸根离子的水解程度,依据溶液中的离子关系分析判断;
A.依据溶液中电荷守恒分析判断;
B.溶液呈酸性说明醋酸电离大于醋酸根离子的水解程度;
C.依据物料守恒和电荷守恒、消去钠离子的浓度;
D.依据物料守恒分析判断.
解答 解:(1)溶液中c(H+)=$\frac{{K}_{w}}{C(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol/L,pH=-lgc(H+)=-lg10-12=12;
故答案为:12;
(2)混合溶液中c(OH-)=$\frac{c(KOH)V(KOH)-c(H+)V({H}_{2}S{O}_{4})×2}{V(NaOH)+V({H}_{2}S{O}_{4})}$=$\frac{0.4mol/L×0.1L-0.1mol/L×2×0.1L}{0.1L+0.1L}$=0.1mol/L,
c(H+)=$\frac{{K}_{w}}{C(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+)=-lg10-13=13;
故答案为:13;
(2)①A.当溶液为酸性时,可以满足关系:CY->CX+>CH+>COH-,故A正确;
B.当溶液呈碱性时可以满足CX+>CY->COH->CH+,故B正确;
C.由电荷守恒CH++CX+=CY-+COH-,可知,该关系CH+>CY->CX+>COH- 无法满足电荷守恒,故C错误;
D.当溶液呈碱性,且YOH远远过量时可以满足COH->CX+>CH+>CY-,故D正确;
故答案为:C;
②A.0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后,得到的是同浓度的CH3COOH和CH3COONa溶液,溶液中电荷守恒:c (Na+)+c (H+)=c (OH-)+c (CH3COO-),c (H+)>c (OH-),得到(CH3COO-)>c (Na+),故A错误;
B.0.02mol•L-1CH3COOH溶液和0.01mol•L-1NaOH溶液以等体积混和后,得到的是同浓度的CH3COOH和CH3COONa溶液,溶液呈酸性说明醋酸电离大于醋酸根离子的水解程度,c (CH3COOH)<c (CH3COO-),故B错误;
C.溶液中电荷守恒得到:c (Na+)+c (H+)=c (OH-)+c (CH3COO-),物料守恒为c (CH3COOH)+c (CH3COO-)=2c (Na+),则2c (H+)=2c (OH-)+c (CH3COO-)-c (CH3COOH),故C错误;
D.等体积混合,浓度缩小为原来的一半,依据溶液中物料守恒得到:c (CH3COOH)+c (CH3COO-)=0.01 mol•L-1;故D正确;
故答案为:D.
点评 本题考查离子浓度大小比较、pH的有关计算,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力的考查,明确pH的计算方法、溶液中的守恒关系即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
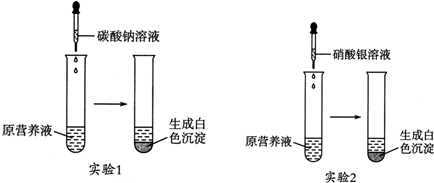
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CO2+4HCl.
CO2+4HCl.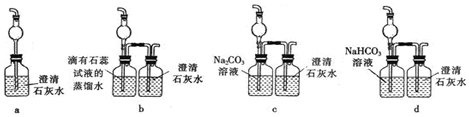
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
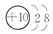 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
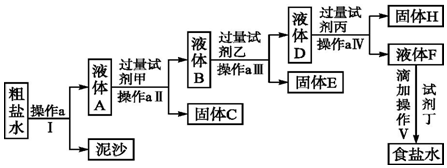
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
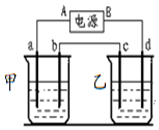 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com