
判断正误,正确的划“√”,错误的划“×”
(1)Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液( )
(2014·广东理综,9D)
(2)溶解度小的沉淀易向溶解度更小的沉淀转化,所以ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀( )
(2014·安徽理综,12D)
(3)验证Fe(OH)3的溶解度小于Mg(OH)2,可将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色( )
(2014·四川理综,4D)
(4)25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度( )
(2014·重庆理综,3D)
(5)AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)( )
(2013·重庆理综,2D)
(6)CaCO3难溶于稀硫酸,也难溶于醋酸( )
(2013·天津理综,5B)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化合物A的相对分子质量为86,碳的质量分数为55.8%,氢的质量分数为7.0%,其余为氧,A的相关反应如图所示。

已知R—CH===CHOH(烯醇)不稳定,很快转化为R—CH2CHO。
根据以上信息回答下列问题:
(1)A的分子式为________,A的结构简式为______________________________________。
(2)反应①的化学方程式为____________________________________________________。
(3)反应②的化学方程式为____________________________________________________。
(4)A的一种同分异构体分子中只有两种不同化学环境的氢原子,所有碳原子不在一条直线上,它的结构简式为________________;它能发生的典型反应的反应类型为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学---物质结构与性质]
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为______________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知溶液中存在平衡:
Ca(OH)2(s)??Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A.①⑥ B.①⑥⑦
C.②③④⑥ D.①②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列有关说法正确的是( )
A.除去工业废水中的Cu2+可以选用FeS作沉淀剂
B.将足量CuSO4溶解在0.1 mol·L-1 H2S溶液中,Cu2+的最大浓度为1.3×10-35 mol·L-1
C.因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生
D.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
1.0 L模拟海水?(25.0 ℃ pH=8.3) 

| 模拟海水中的离子浓度/mol·L-1Na+ | Mg2+ | Ca2+ | Cl- | HCO |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9
Ksp(MgCO3)=6.82×10-6
Ksp[Ca(OH)2]=4.68×10-6
Ksp[Mg(OH)2]=5.61×10-12
下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。下列分析不正确的是( )
A滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s)??
Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是:
A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种
B.第三周期元素的离子半径大小比较:Cl->S2->Na+>Mg2+>Al3+
C.日本福岛核电站释放出的放射性核素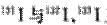 互为同位素
互为同位素
D.相同条件下,测定同浓度的H2CO3溶液和H2SO4溶液的酸性,可比较C和S的非金属性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com