
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
【答案】Fe2+ + CO32- = FeCO3↓ 稀硫酸(或稀盐酸等,合理答案均可得分) 沉淀颜色由白色变为灰绿色,最终变为红褐色 Fe2+ + 2HCO3- = FeCO3↓+ CO2↑+ H2O 4FeCO3 + O2 + 6H2O = 4Fe(OH)3 + 4CO2 混合以后,虽然实验b中c(NaHCO3)比实验a中c(Na2CO3)大,但Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强
【解析】
解答本题主要抓住Fe(OH)2和FeCO3的区别进行分析,FeCO3能与酸反应产生气体;能被空气中的氧气氧化为红褐色的氢氧化铁,据此分析解答。
(1)实验a中FeSO4与Na2CO3溶液混合若生成的沉淀是FeCO3,则发生复分解反应,反应的离子方程式为:Fe2+ + CO32- = FeCO3↓;FeCO3溶于硫酸或盐酸产生二氧化碳气体,而氢氧化亚铁与硫酸或盐酸反应不会产生气体,则可用稀硫酸或盐酸来鉴别碳酸亚铁和氢氧化亚铁沉淀,
故答案为:Fe2+ + CO32- = FeCO3↓;稀硫酸(或稀盐酸);
(2)若沉淀中有Fe(OH)2,放置在空气中会被氧化而呈现白色沉淀迅速变成灰绿色,最终变成红褐色的现象,
故答案为:沉淀颜色由白色变为灰绿色,最终变为红褐色;
(3)实验b中的反应物为硫酸亚铁和碳酸氢钠,两者反应除了生成碳酸亚铁沉淀,还有二氧化碳气体和水生成,反应的离子方程式为:Fe2+ + 2HCO3- = FeCO3↓+ CO2↑+ H2O,
故答案为:Fe2+ + 2HCO3- = FeCO3↓+ CO2↑+ H2O;
(4) FeCO3被氧气氧化生成红褐色的氢氧化铁,反应中氧气为氧化剂,碳酸亚铁为还原剂,由氧化还原反应规律可得反应的化学方程式为:4FeCO3 + O2 + 6H2O = 4Fe(OH)3 + 4CO2,
故答案为:4FeCO3 + O2 + 6H2O = 4Fe(OH)3 + 4CO2;
(5) 对比实验a、b,不同之处在于前者反应物为碳酸钠溶液,后者为碳酸氢钠溶液,由于碳酸根离子的水解程度较碳酸根离子的水解大,实验a中混合溶液氢氧根离子浓度较实验b中要大,导致实验a中更易产生Fe(OH)2沉淀,
故答案为:混合以后,虽然实验b中c(NaHCO3)比实验a中c(Na2CO3)大,但Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
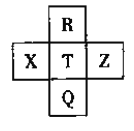
A. 非金属性:Z<T<X
B. R与Q的电子数相差26
C. 气态氢化物稳定性:R<T<Q
D. 最高价氧化物的水化物的酸性:Q>T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中三种元素a、b、c在周期表中的位置如图所示,下列有关这三种元素的说法正确的是
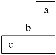
A. a是一种活泼的非金属元素B. b的气态氢化物比c的稳定
C. c的氧化物对应的水化物是强酸D. b元素的最高化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为______________(用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素(-1价)最终氧化成SO42-,写出制备二氧化氯的离子方程式_____________________________________。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。

生产漂白粉反应的化学方程式为_____________________。实际生产中,将石灰乳(含有3%-6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_____________________________。
(4)用莫尔法可以测定溶液中Cl-的含量。莫尔法是一种沉淀滴定法,用标准AgNO3溶液滴定待测液,以K2CrO4为指示剂,滴定终点的现象是溶液中出现砖红色沉淀(Ag2CrO4)。已知平衡Cr2O72-+H2O![]() 2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
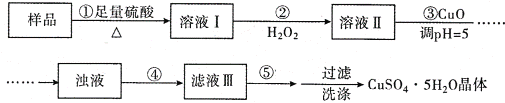
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
A. CuSO4发生了氧化反应 B. 生成1 mol H3PO4时,有10 mol 电子转移
C. 白磷只作还原剂 D. 氧化产物和还原产物的物质的量之比为6∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反
应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
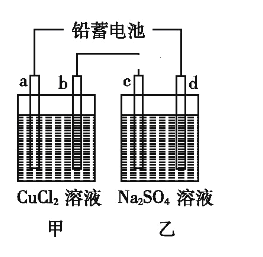
A. d极为阴极
B. 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-PbSO4 (s)+2H2O (l)
C. 若利用甲池精炼铜,b极应为粗铜
D. 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com