
 N和Si是合成新型非金属材料的两种重要元素.请回答:
N和Si是合成新型非金属材料的两种重要元素.请回答: ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.分析 (1)硅是14号元素,价层有4个电子,分布在s轨道上p轨道上,Si2H6中每个Si原子与氢原子之间形成三对共用电子对,硅原子与硅原子之间也有一对共用电子对,据此判断价层电子对数目;
(2)根据价层电子对互斥理论确定原子杂化方式,O原子最外层为2p轨道上有未成对的电子,ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,ClO3-中共价键数为3+$\frac{1}{2}$×(7+1-3×2)=4(含1对孤对电子),ClO4-中共价键数为4+$\frac{1}{2}$×(7+1-2×4)=4(不含孤对电子),根据价层电子对互斥理论判断微粒空间构型;
(3)N和Si形成的原子晶体中,N原子最外层有5个电子,可以形成3个共价键;
(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;N3-与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(5)①晶胞中最小的环含有12个原子;
②金刚石晶胞中4个C原子在晶胞内部,6个C原子在面心上、8个C原子分别位于8个顶点上,所以该晶胞中C原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的$\frac{1}{4}$.
解答 解:(1)硅是14号元素,价层有4个电子,分布在s轨道上p轨道上,Si原子的价层电子排布图为 ,Si2H6中每个Si原子与氢原子之间形成三对共用电子对,硅原子与硅原子之间也有一对共用电子对,所硅原子价层电子对数为4,
,Si2H6中每个Si原子与氢原子之间形成三对共用电子对,硅原子与硅原子之间也有一对共用电子对,所硅原子价层电子对数为4,
故答案为: ;4;
;4;
(2)ClO3-、ClO4-中Cl的价层电子对数都是$\frac{7+1}{2}$=4,O原子最外层为2p轨道上有未成对的电子,所以都是以sp3杂化轨道与O原子的2p成键的,ClO3-中共价键数为3+$\frac{1}{2}$×(7+1-3×2)=4(含1对孤对电子),ClO4-中共价键数为4+$\frac{1}{2}$×(7+1-2×4)=4(不含孤对电子),根据价层电子对互斥理论判断微粒的立体结构分别为三角锥形、正四面体形,
故答案为:sp3;2p; 三角锥形; 正四面体形;
(3)N原子最外层有5个电子,可以形成3个共价键,所以其配位数是3,故答案为:3;
(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3-与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3-中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
故答案为:电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B;
(5)①根据图知,每个最小环上含有6个Si原子、6个O原子,所以晶胞中最小的环含有12个原子,故答案为:12;
②金刚石晶胞中4个C原子在晶胞内部,6个C原子在面心上、8个C原子分别位于8个顶点上,所以该晶胞中C原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,该晶胞体积=$\frac{\frac{60}{{N}_{A}}×8}{ρ}$cm3,晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{\frac{60}{{N}_{A}}×8}{ρ}}$cm=$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{480ρ}{{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{480ρ}{{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{480ρ}{{N}_{A}}}$×1010pm,
故答案为:$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{480ρ}{{N}_{A}}}$×1010.
点评 本题考查物质结构和性质,为高考常考查点,涉及晶胞计算、价层电子对互斥理论、等电子体等知识点,侧重考查学生知识应用及计算能力、空间想象能力,难点是(5)晶胞计算,知道“两个最近的Si原子核之间的距离与晶胞体长”关系是解该题关键,注意cm与pm单位之间的换算.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:推断题
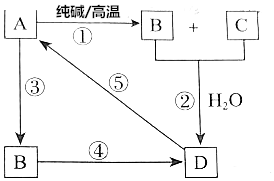 已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.
已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
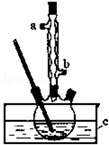 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
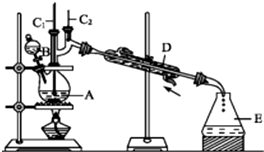 正丁醛是一种化工原料.
正丁醛是一种化工原料.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C的体积分数降低 | B. | x+y>z | ||
| C. | 平衡向正反应方向移动 | D. | x+y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C5H12 | C7H16 | C8H16 |
| A. | 13 | B. | 14 | C. | 10 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com