
| A. | 亚硫酸钠 | B. | 氢氧化钠 | C. | 过氧化钠 | D. | 碳酸氢钠 |
科目:高中化学 来源: 题型:实验题
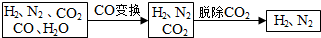
| Na2CO3 | K2CO3 | |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
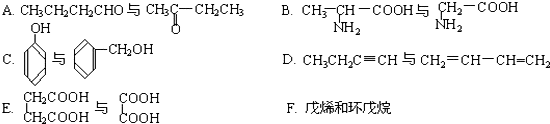
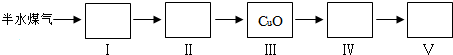
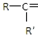 $\frac{\underline{\;氧化成\;}}{\;}$
$\frac{\underline{\;氧化成\;}}{\;}$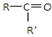 (R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
(R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.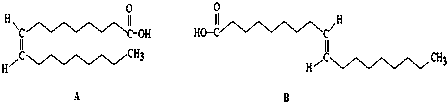
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素的氢化物中沸点最低的是HF | |
| B. | 因为H2O分子间有氢键,所以H2O比H2S稳定 | |
| C. | 一个X原子的质量为ag,则X元素的相对原子质量为aNA | |
| D. | 熔沸点:NH3<PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 新鲜蔬菜做熟后,所含维生素C会有损失 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com