
 Ņ½Ń§ÉĻ³£ÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗŗĶ²ŻĖįČÜŅŗµÄ·“Ó¦ÓĆÓŚ²ā¶ØŃŖøʵÄŗ¬Į森»Ų“šĻĀĮŠĪŹĢā£ŗ
Ņ½Ń§ÉĻ³£ÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗŗĶ²ŻĖįČÜŅŗµÄ·“Ó¦ÓĆÓŚ²ā¶ØŃŖøʵÄŗ¬Į森»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö £Ø1£©øĆ·“Ó¦ÖŠ£¬MnŌŖĖŲ»ÆŗĻ¼ŪÓÉ+7¼Ū±äĪŖ+2¼Ū”¢CŌŖĖŲ»ÆŗĻ¼ŪÓÉ+3¼Ū±äĪŖ+4¼Ū£¬ĘäµĆŹ§µē×Ó×īŠ”¹«±¶ŹżŹĒ5£¬ŌŁ½įŗĻŌ×ÓŹŲŗć”¢µēŗÉŹŲŗćÅäĘ½·½³ĢŹ½£»
£Ø2£©Ź§µē×Ó»ÆŗĻ¼ŪÉżøߵķ“Ó¦ĪļŹĒ»¹Ō¼Į£¬·¢ÉśŃõ»Æ·“Ó¦²śĪļĪŖŃõ»Æ²śĪļ£»
£Ø3£©øł¾ŻøßĆĢĖį¼ŲŗĶ×ŖŅʵē×ÓÖ®¼äµÄ¹ŲĻµŹ½¼ĘĖć£»
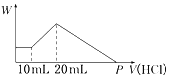
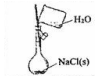
£Ø4£©½«ÓÉNaOH”¢AlCl3”¢MgCl2ČżÖÖ¹ĢĢå×é³ÉµÄ»ģŗĻĪļČÜÓŚ×ćĮæĖ®£¬³ä·Ö·“Ó¦ŗóµĆµ½0.58g°×É«³Įµķ£¬ĻņĖłµĆµÄ×ĒŅŗÖŠ¼ÓČėŃĪĖįŹ±£¬0-10mLŹ±Ć»ÓŠ³ĮµķÉś³É£¬ĖµĆ÷ČÜŅŗÖŠNaOH¹żĮ棬ŌņĀĮĄė×ÓĶźČ«×Ŗ»ÆĪŖĘ«ĀĮĖįøłĄė×Ó£¬°×É«³ĮµķĪŖMg£ØOH£©2£¬øł¾ŻMgŌŖĖŲŹŲŗć£ŗn£ØMgCl2£©=n”¾Mg£ØOH£©2”棻
¼ÓČėŃĪĖį10-20mL£¬ŃĪĖįŗĶĘ«ĀĮĖįÄĘ·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³Įµķ£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗH2O+AlO2-+H+=Al£ØOH£©3”ż£¬³Įµķ×ī“óŹ±£¬ČÜŅŗÖŠ“ęŌŚµÄČÜÖŹŹĒĀČ»ÆÄĘ£¬³ĮµķĪŖMg£ØOH£©2”¢Al£ØOH£©3£¬øł¾ŻĄė×Ó·½³Ģ¼ĘĖćn”¾Al£ØOH£©3”棬ŌŁøł¾ŻAlŌŖĖŲŹŲŗć¼ĘĖćn£ØAlCl3£©£»
¼ÓČė20-PmLŃĪĖį£¬ĒāŃõ»ÆĆ¾ŗĶĒāŃõ»ÆĀĮ¶¼ÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĀĮŗĶĀČ»ÆĆ¾£¬ČÜŅŗÖŠµÄČÜÖŹŹĒĀČ»ÆĀĮ”¢ĀČ»ÆĆ¾ŗĶĀČ»ÆÄĘ£¬PµćĖł¼ÓŃĪĖįÓĆÓŚÖŠŗĶŌ»ģŗĻĪļÖŠµÄNaOH£¬“ĖŹ±Ėł¼ÓŃĪĖįĪļÖŹµÄĮæ£ŗn£ØHCl£©=n£ØNaOH£©£¬³Įµķ×ī“óŹ±£¬ČÜŅŗÖŠ“ęŌŚµÄČÜÖŹŹĒĀČ»ÆÄĘ£¬ÓÉNa+Ąė×ÓŗĶCl-Ąė×ÓŹŲŗćµĆ£¬Ō»ģŗĻĪļÖŠn£ØNaOH£©=n£ØNaCl£©=n£ØCl-£©=2n£ØMgCl2£©+3n£ØAlCl3£©+n£ØHCl£©£¬½ų¶ų¼ĘĖćPµć¼ÓČėŃĪĖįµÄĢå»ż£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬Éś³ÉĪļÖŠ»¹ŗ¬ÓŠĖ®£¬øĆ·“Ó¦ÖŠMnŌŖĖŲ»ÆŗĻ¼ŪÓÉ+7¼Ū±äĪŖ+2¼Ū”¢CŌŖĖŲ»ÆŗĻ¼ŪÓÉ+3¼Ū±äĪŖ+4¼Ū£¬Ęä×ŖŅʵē×Ó×ÜŹżĪŖ10£¬ĖłŅŌMnO4-”¢H2C2O4µÄ¼ĘĮæŹż·Ö±šŹĒ2”¢5£¬ŌŁ½įŗĻŌ×ÓŹŲŗćÅäĘ½·½³ĢŹ½ĪŖ6H++2MnO4-+5H2C2O4=10CO2”ü+2Mn2++8H2O£¬
¹Ź“š°øĪŖ£ŗ6£»2£»5£»10£»2£»8H2O£»
£Ø2£©Ź§µē×Ó»ÆŗĻ¼ŪÉżøߵķ“Ó¦ĪļH2C2O4ŹĒ»¹Ō¼Į£¬·¢ÉśŃõ»Æ·“Ó¦£¬
¹Ź“š°øĪŖ£ŗH2C2O4£»
£Ø3£©øł¾ŻMnO4-”«5e-µĆ£¬·“Ó¦×ŖŅĘĮĖ0.4molµē×Ó£¬ŌņĻūŗÄKMnO4µÄĪļÖŹµÄĮæ=$\frac{0.4mol}{5}$=0.08mol£¬
¹Ź“š°øĪŖ£ŗ0.08£¬
£Ø4£©½«ÓÉNaOH”¢AlCl3”¢MgCl2ČżÖÖ¹ĢĢå×é³ÉµÄ»ģŗĻĪļČÜÓŚ×ćĮæĖ®£¬³ä·Ö·“Ó¦ŗóµĆµ½0.58g°×É«³Įµķ£¬ĻņĖłµĆµÄ×ĒŅŗÖŠ¼ÓČėŃĪĖįŹ±£¬0-10mLŹ±Ć»ÓŠ³ĮµķÉś³É£¬ĖµĆ÷ČÜŅŗÖŠNaOH¹żĮ棬ŌņĀĮĄė×ÓĶźČ«×Ŗ»ÆĪŖĘ«ĀĮĖįøłĄė×Ó£¬°×É«³ĮµķĪŖMg£ØOH£©2£¬¼ÓČėŃĪĖį10-20mL£¬ŃĪĖįŗĶĘ«ĀĮĖįÄĘ·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³Įµķ£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗH2O+AlO2-+H+=Al£ØOH£©3”ż£¬³Įµķ×ī“óŹ±£¬ČÜŅŗÖŠ“ęŌŚµÄČÜÖŹŹĒĀČ»ÆÄĘ£¬³ĮµķĪŖMg£ØOH£©2”¢Al£ØOH£©3£¬¼ÓČė20-PmLŃĪĖį£¬ĒāŃõ»ÆĆ¾ŗĶĒāŃõ»ÆĀĮ¶¼ÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĀĮŗĶĀČ»ÆĆ¾£¬ČÜŅŗÖŠµÄČÜÖŹŹĒĀČ»ÆĀĮ”¢ĀČ»ÆĆ¾ŗĶĀČ»ÆÄĘ£¬
¢ŁĪ“¼ÓŃĪĖįŹ±µÄ³ĮµķŹĒĒāŃõ»ÆĆ¾£¬Ōņn”¾Mg£ØOH£©2”æ=$\frac{0.58g}{58g/mol}$=0.01mol£¬øł¾ŻMgŌ×ÓŹŲŗćµĆn£ØMgCl2£©=n”¾Mg£ØOH£©2”æ=0.02mol£¬ŃĪĖįŗĶĘ«ĀĮĖįÄĘ·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³Įµķ£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖH2O+AlO2-+H+=Al£ØOH£©3”ż£¬øł¾ŻHClµÄĢå»żÖŖ£¬n£ØAlO2-£©=n£ØHCl£©=0.5mol/L”Į£Ø0.02-0.01£©L=0.005mol£¬øł¾ŻĀĮŌ×ÓŹŲŗćµĆn£ØAlCl3£©=n£ØAlO2-£©=0.005mol£¬³Įµķ×ī“óŹ±£¬ČÜŅŗÖŠ“ęŌŚµÄČÜÖŹŹĒĀČ»ÆÄĘ£¬ÓÉNa+Ąė×ÓŗĶCl-Ąė×ÓŹŲŗćµĆ£¬Ō»ģŗĻĪļÖŠn£ØNaOH£©=n£ØNaCl£©=n£ØCl-£©=2n£ØMgCl2£©+3n£ØAlCl3£©+n£ØHCl£©=0.01mol”Į2+0.005mol”Į3+0.02L”Į0.5mol/L=0.045mol£¬m£ØNaOH£©=0.045mol”Į40g/mol=1.8g£¬
¹Ź“š°øĪŖ£ŗ1.8£»
¢ŚPµćČÜÖŹŹĒĀČ»ÆĀĮ”¢ĀČ»ÆĆ¾ŗĶĀČ»ÆÄĘ£¬Ėł¼ÓŃĪĖįÓĆÓŚÖŠŗĶŌ»ģŗĻĪļÖŠµÄNaOH£¬“ĖŹ±Ėł¼ÓŃĪĖįĪļÖŹµÄĮæĪŖ£ŗn£ØHCl£©=n£ØNaOH£©£¬³Įµķ×ī“óŹ±£¬ČÜŅŗÖŠ“ęŌŚµÄČÜÖŹŹĒĀČ»ÆÄĘ£¬ÓÉNa+Ąė×ÓŗĶCl-Ąė×ÓŹŲŗćµĆ£¬Ō»ģŗĻĪļÖŠn£ØNaOH£©=n£ØNaCl£©=n£ØCl-£©=2n£ØMgCl2£©+3n£ØAlCl3£©+n£ØHCl£©=0.01mol”Į2+0.005mol”Į3+0.02L”Į0.5mol/L=0.045mol£¬
ĖłŅŌPµć¼ÓČėŃĪĖįµÄĢå»żĪŖ£ŗ$\frac{0.045mol}{0.5L}$=0.09L=90mL£¬
¹Ź“š°øĪŖ£ŗ90£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦ŅŌ¼°¹ŲÓŚ»Æѧ·“Ó¦Ķ¼Ļó»ģŗĻĪļµÄ¼ĘĖć£¬Ć÷Č·Ńõ»Æ»¹Ō·“Ó¦ÖŠµĆŹ§µē×ÓŹŲŗćŹĒ½āĢā¹Ų¼ü£¬µŚ£Ø4£©Š”Ģā×ŪŗĻæ¼²éѧɜ·ÖĪö¼ĘĖćÄÜĮ¦£¬×¢ŅāĄūÓĆŹŲŗć½ųŠŠ½ā“š£¬ÓŠŅ»¶ØÄŃ¶Č£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 |  |  |  |
| A£®¶ĮȔȷ¶ØÖÕµćŹ±µÄŹż¾ŻĪŖ21.80mL | B£®ŹµŃéŹŅÖĘČ”°±Ęų | C£®ÓƱ½ŻĶČ”µāĖ®ÖŠµÄI2ŗ󣬷ÖŅŗ | D£®ÅäÖĆ0.10mol/L NaClČÜŅŗ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ·¢¶Æ»śµÄĄąŠĶ | ·¢¶Æ»ś»ģŗĻĘųÖŠĘūÓĶÓėæÕĘųµÄÖŹĮæ±Č | ·¢¶Æ»śŌĖ×ŖµÄĪĀ¶Č | Ī²ĘųÖŠCOµÄŗ¬Įæ | Ī²ĘųÖŠNO3µÄŗ¬Įæ |
| ĘÕĶØ·¢¶Æ»ś | 1£ŗ15 | ½Ļøß | ½Ļøß | ½Ļøß |
| Ļ”±”Č¼ÉÕ·¢¶Æ»ś | 1£ŗ40 | ½ĻµĶ | ½ĻµĶ | ½ĻµĶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĄūÓĆ“ß»ÆÉ菩£¬æÉŅŌ½«Ęū³µĪ²ĘųÖŠCOŗĶNO×Ŗ»ÆĪŖĪŽŗ¦ĘųĢå | |
| B£® | ÓĆČȵēæ¼īČÜŅŗĻ“Č„ÓĶĪŪ£¬ŌĄķŹĒNa2CO3ČÜŅŗĖ®½āĻŌ¼īŠŌ | |
| C£® | øßĢśĖį¼Ų£ØK2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ”¢øߊ§”¢¶ą¹¦ÄÜĖ®“¦Ąķ¼Į£¬¼ČÄÜɱ¾śĻū¶¾ÓÖÄܾ»Ė® | |
| D£® | ¹āµ¼ĻĖĪ¬µÄÖ÷ŅŖ³É·ÖŹĒ¾§Ģå¹č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
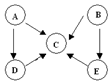 A”¢B”¢C”¢D”¢EĪåÖÖĪļÖŹÖŠŗ¬ÓŠĶ¬Ņ»ÖÖŌŖĖŲ£¬ĘäĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ĘäÖŠA”¢B”¢C”¢DŌŚ³£ĪĀĻĀ¶¼ŹĒĘųĢ壬BĪŖŗģ×ŲÉ«£®
A”¢B”¢C”¢D”¢EĪåÖÖĪļÖŹÖŠŗ¬ÓŠĶ¬Ņ»ÖÖŌŖĖŲ£¬ĘäĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ĘäÖŠA”¢B”¢C”¢DŌŚ³£ĪĀĻĀ¶¼ŹĒĘųĢ壬BĪŖŗģ×ŲÉ«£®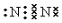 £¬DµÄ½į¹¹Ź½£ŗ
£¬DµÄ½į¹¹Ź½£ŗ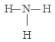 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
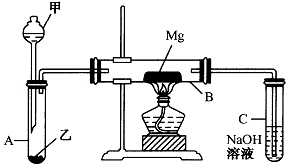 ŅŃÖŖSiO2”¢SO2ŗĶCO2¶¼ŹĒĖįŠŌŃõ»ÆĪļ£¬»ÆѧŠŌÖŹ¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£»MgŗĶNaµÄ»ÆѧŠŌÖŹŅ²¾ßÓŠŅ»¶ØĻąĖĘŠŌ£®
ŅŃÖŖSiO2”¢SO2ŗĶCO2¶¼ŹĒĖįŠŌŃõ»ÆĪļ£¬»ÆѧŠŌÖŹ¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£»MgŗĶNaµÄ»ÆѧŠŌÖŹŅ²¾ßÓŠŅ»¶ØĻąĖĘŠŌ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaOHČÜŅŗÓėSO2·“Ó¦£¬µ±n£ØNaOH£©£ŗn£ØSO2£©=4£ŗ3Ź±£ŗ4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B£® | Ļņŗ¬1molµÄNaOHČÜŅŗÖŠĶØČė1molµÄH2SĘųĢå£ŗH2S+2OH-=S2-+2H2O | |
| C£® | Ca£ØHCO3£©2ČÜŅŗÓėÉŁĮæNaOHČÜŅŗ·“Ó¦£ŗHCO3-+Ca2++OH-=CaCO3”ż+H2O | |
| D£® | 1mol/LµÄNaAlO2ČÜŅŗŗĶ2.5mol/LµÄHClµČĢå»ż»„Ļą¾łŌČ»ģŗĻ£ŗ2AlO2-+5H+=Al£ØOH£©3”ż+Al3++H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ij·“Ó¦Õż”¢Äę·“Ó¦µÄ»ī»ÆÄÜ·Ö±šĪŖEakJ/mol”¢EbkJ/mol£¬Ōņ”÷H=-£ØEa-Eb£©kJ/mol | |
| B£® | H2µÄČČÖµĪŖ142.9kJ/g£¬ŌņÓŠ2H2£Øg£©+O2£Øg£©ØT2H2O £Ø1£©”÷H=-285.8kJ/mol | |
| C£® | ½«ÅضČĪŖ0.1mol/LHFČÜŅŗ¼ÓĖ®²»¶ĻĻ”ŹĶ¹ż³ĢÖŠ£¬$\frac{c£Ø{F}^{-}£©}{c£Ø{H}^{+}£©}$Ź¼ÖÕ±£³Ö¼õŠ” | |
| D£® | »ģŗĻĒ°$\frac{c£ØC{H}_{3}COOH£©}{c£ØNaOH£©}$=2£¬µČĢå»żµÄ»ģŗĻŗóČÜŅŗÖŠ£ŗ$\frac{c£Ø{H}^{+}£©}{c£ØO{H}^{-}£©}$=$\frac{c£ØC{H}_{3}COOH£©}{c£ØC{H}_{3}CO{O}^{-}£©}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1molOH-µÄÖŹĮæŹĒ17g | B£® | 1molĘųĢåĖłÕ¼µÄĢå»żµČÓŚ22.4L | ||
| C£® | ĒāĘųµÄĦ¶ūÖŹĮæŹĒ2g | D£® | Ħ¶ūŹĒĪļÖŹµÄÖŹĮ浄Ī» |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com