
一定条件下,0.3molX(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)  2Z(g), ΔH=-aKJ/mol,下列说法正确的是
2Z(g), ΔH=-aKJ/mol,下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,且反应放出0.1aKJ的热量
C. 达到平衡后,若向平衡体系中充入西游气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源:2017届河南省天一大联考高三阶段性测试(四)(b卷)理综化学试卷(解析版) 题型:简答题
碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 •2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g •L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ• mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ• mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g)  CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
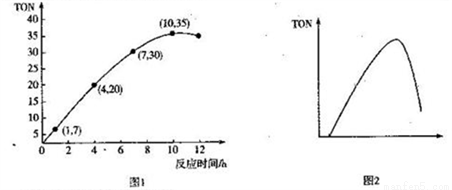
已知:TON=
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
弱酸 | 碳酸 | 次氯酸 |
电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol • L-1 NaClO 溶液的 pH=________________。
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:选择题
向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应(不考虑CO2的溶解),下列说法不正确的是
A. 当a≥2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O
B. 当a=1.25b时,发生的离子方程式为:5OH-+4CO2=3HCO3-+CO32-+H2O
C. 2b/3<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b)
D. 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:选择题
某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是
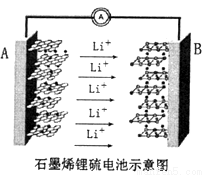
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-=Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:选择题
下列表示正确的是
A. 含8个中子的碳原子核素符号:12C B. HF的电子式: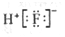
C. Cl-的结构示意图: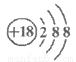 D. CH4分子的比例模型:
D. CH4分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:简答题
硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
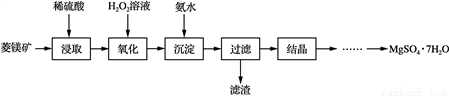
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(1) “氧化”步骤中,加入H2O2溶液的目的是________(用离子方程式表示)。“沉淀”步骤中,用氨水调节pH的范围是________。
(2) “过滤”所得滤液中含有的阳离子为Mg2+、________。
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、____________________。
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数________。(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
下列关于乙醇性质的说法正确的是
A. 乙醇是无色无味的液体 B. 乙醇能使紫色石蕊试液变红
C. 乙醇不能与金属钠反应 D. 乙醇能被酸性高锰酸钾溶液氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
下列有关二氧化硫说法中正确的是
A. 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加。
B. 二氧化硫能使品红褪色,加热后不恢复到红色
C. 二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的漂白性
D. 二氧化硫属于碱性氧化物,可以用NaOH溶液吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com