
| 1.344L |
| 22.4L/mol |
| 12×108×11.2 |
| 3×22.4 |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、v(SO2)=4 mol?L-1?min-1 |
| B、v(O2)=3 mol?L-1?min-1 |
| C、v(SO2)=0.1 mol?L-1?s-1 |
| D、v(O2)=0.1 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
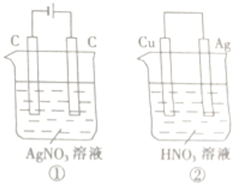 在如图所示的装置中,溶液的体积均为1L,浓度均为0.1mol?L-1.工作一段时间后,测得电路中均通过了0.02mol e-.下列叙述中正确的是( )
在如图所示的装置中,溶液的体积均为1L,浓度均为0.1mol?L-1.工作一段时间后,测得电路中均通过了0.02mol e-.下列叙述中正确的是( )| 选项 | 电极质量变化 | 生成气体的物质的量 |
| A | ①>② | ①>② |
| B | ①<② | ①>② |
| C | ①>② | ①=② |
| D | ①>② | ①<② |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
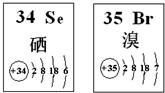
| A、原子半径:Br>Se>P |
| B、还原性:S2->Se2->Br- |
| C、SeO2既有氧化性又有还原性 |
| D、酸性H2SeO4>HBr04 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准状况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1 molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D、0.1 molO3和O2的混合气体中含氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
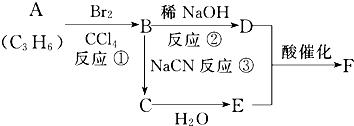 已知溴乙烷跟氰化钠反应后,产物再水解可以得到丙酸,
已知溴乙烷跟氰化钠反应后,产物再水解可以得到丙酸,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com