
| A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O |
| B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ |
| C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ |
| D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、加入铝可以产生H2的溶液中:Al3+、K+、SO42-、Cl- |
| B、在由水电离的c(OH-)=10-14mol?L-1 的溶液中:Fe2+、NH4+、NO3-、Cl- |
| C、在pH=11的溶液中:SO32-、K+、Na+、CO32- |
| D、在酸性溶液中:AlO2-、I一、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
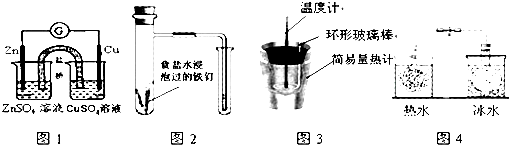
| A、图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
| B、图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C、图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
| D、图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeI2与Cl2物质的量之比为1:1时:2Fe2++2I-+2Cl2=2Fe3++4C1-+I2 |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、将过量的SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O=HClO+HSO3- |
| D、将0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,17.6g丙烷中所含的极性共价键为4NA |
| B、常温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、常温下,将5.6g铁投入到足量浓硝酸中,反应转移的电子数目为0.3NA |
| D、12 g金刚石中含有的共价键数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | 基态原子核外有三个能级,P级能电子处在半充满状态 |
| X | 常见的金属,在周期表中的中期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 存在总质量数为56,中子数为30的核数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com