
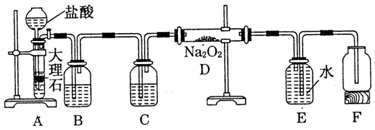
分析 由图可知,A中碳酸钙与盐酸反应生成二氧化碳,B中饱和碳酸氢钠溶液除去HCl,C中利用浓硫酸干燥CO2,D中发生2CO2+2Na2O2=2Na2CO3+O2,E为排水法收集氧气,以此来解答.
解答 解:(1)装置A中发生反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)C中盛有试剂是浓硫酸,可干燥二氧化碳气体,故答案为:浓硫酸;
(3)装置D中发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)A中生成标况下4.48L的CO2气体,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,结合(1)中反应可知消耗n(HCl)=0.4mol,则消耗5mol•L-1的盐酸体积为$\frac{0.4mol}{5mol/L}$=0.08L=80mL,故答案为:80.
点评 本题考查物质的性质实验设计,为高频考点,把握实验装置的作用、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意结合方程式及物质的量浓度公式计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | H2CO3 | C. | HCN | D. | HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com