
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
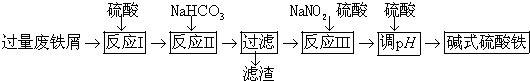
分析 废铁屑(含少量氧化铝、氧化铁等),将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应Ⅱ中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,
(1)Fe为活泼金属,可与酸反应生成氯化亚铁和氢气,氧化铁与酸反应生成铁离子,铁离子可以氧化Fe反应生成硫酸亚铁;
(2)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4≤pH<7.5之间,
(3)反应Ⅲ中生成的气体空气变红棕色是生成一氧化氮气体,反应Ⅲ是亚铁离子被亚硝酸钠酸性溶液中发生氧化还原反应生成硝酸铁,一氧化氮和水;
(4)n(O2)=1mol,则得到电子1mol×4=4mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要4molNaNO2;
(5)Fe3+沉淀完全时的pH=3.1,若酸度太低,碱性增强,易生成氢氧化铁沉淀;若加入硫酸过大,氢离子浓度增大,会中和Fe(OH)SO4中的氢氧根离子,不利于碱式硫酸铁的生成;
(6)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式.
解答 解:(1)活泼金属,可与酸反应,反应的离子方程式为Fe+2H+═Fe2++H2↑,氧化铁与酸反应生成铁离子,铁离子可以氧化Fe,离子方程式为:Fe+2Fe3+═3Fe2+,
故答案为:Fe+2H+═Fe2++H2↑、Fe+2Fe3+═3Fe2+;
(2)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4≤pH<7.5之间,
故答案为:4.4≤pH<7.5;
(3)NaNO2可氧化亚铁离子为铁离子,本身变为NO,故反应方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O,
故答案为:2H++Fe2++NO2-=Fe3++NO↑+H2O;
(4)n(O2)=1mol,则得到电子1mol×4=4mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要4molNaNO2,
故答案为:4;
(5)Fe3+沉淀完全时的pH=3.1,若酸度太低,碱性增强,易生成氢氧化铁沉淀;若加入硫酸过大,氢离子浓度增大,会中和Fe(OH)SO4电离的氢氧根离子,Fe(OH)SO4?Fe2++2OH-+SO42-,使电离平衡向右移动,不利于碱式硫酸铁的生成;
故答案为:过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成;
(6)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+,
故答案为:2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
点评 本题考查工艺流程、对条件的控制选择、物质的分离提纯等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的化学性质比氧气稳定 | |
| B. | 常温、常压下,溴呈液态,碘呈固态 | |
| C. | 稀有气体一般很难发生化学反应 | |
| D. | 相同状态下,氯气的密度比空气的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

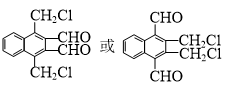 .
.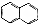 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;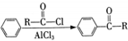 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和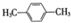 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
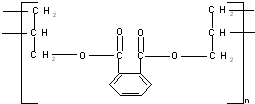
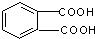 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 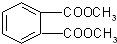
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
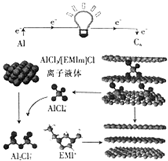 英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为Cn(AlCl4-)+e-═Cn+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-5△H2-12△H3 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | 12△H3+5△H2-2△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com