
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
分析下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)===2N2O(g)ΔH=+163 kJ·mol-1
B.Ag(s)+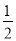 Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+ O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)===  O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为________________;己知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是____________________。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___________Si(填“>”、“<”)。与Si同周期部分元素的电离能如下图所示,其中a、b和c分别代表____________。
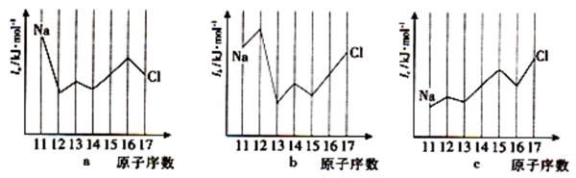
A.a为Il、b为I2、c为I3B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1D.a为Il、b为I3、c为I2
(3) SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为____________;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为_____________。
(4)镓与某有机物形成的配合物过程如下图(左),在图上画出产物中的配位键。
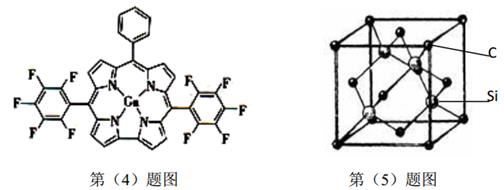
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如上图(右)所示,则Si原子的配位数为___________,每个C原子周围最近的C原子数目为___________个;若晶胞的边长为a pm,则金刚砂的密度表达式为___________g/cm3。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列说法错误的是( )
A.18g冰的晶体中含有氢键的数目为2NA
B.11.2 L丙烷(标准状况)中含有σ键的数目为5NA
C.2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA
D.1molCl2与足量NaOH溶液反应,转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期9月月考化学试卷(解析版) 题型:推断题
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:填空题
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一固定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.向装置中再充入SO3
(3)求该反应达到平衡时SO2的转化率为(用百分数表示) 。
(4)若将平衡混合气体的5%通入过量的Ba(OH)2溶液,生成沉淀 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是
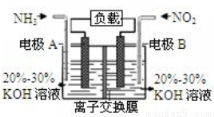
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有4.48LNO2(标准状况)被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:填空题
高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:

根据上述流程图填空:
(1)“除杂”操作是先加入过氧化氢充分反应后,再用氨水调节溶液的pH,使硫酸铵溶液中的少量Fe2+氧化为Fe3+并进一步转化为Fe(OH)3从而除去Fe2+,则Fe2+酸性条件下氧化为Fe3+的离子方程式为:
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(3)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(4)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,铵明矾属于 (填“纯净物”或“混合物”)在0.1mol/L铵明矾的水溶液中,浓度最大的离子是 。
(5)热分解中发生如下反应6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 9H2O,当生成1mol Al2O3时转移电子物质的量为 mol
(6)往含0.1mol铵明矾稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,反应的总离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高二9月月考化学卷(解析版) 题型:选择题
在密闭容器中发生反应m A(g)+n B(g)===pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是
A.m+n>p B.平衡向逆反应方向移动
C.A的转化率提高 D.C的体积分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com