
| A. | 铁丝在空气中燃烧,火星四射,产生红棕色的烟 | |
| B. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 在试管中加热铜绿有黑色固体生成 | |
| D. | 人造丝在酒精灯的火焰上灼烧会产生烧焦羽毛的气味 |
分析 A、铁丝在氧气中剧烈燃烧,火星四射,生成一种黑色固体;
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰;
C、铜绿受热分解会生成黑色的氧化铜;
D、蛋白质灼烧时能发出烧焦羽毛味.
解答 解:A、铁丝在氧气中剧烈燃烧,火星四射,生成一种黑色固体,在空气中不能燃烧,故A错误;
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰,故B正确;
C、铜绿受热分解会生成黑色的氧化铜,所以在试管中加热铜绿有黑色固体生成,故C正确;
D、蛋白质灼烧时能发出烧焦羽毛味,人造丝不是蛋白质,所以不会产生烧焦羽毛的气味,故D错误.
故选:AD.
点评 实验现象的描述是化学实验考查的重点和热点,要注意区分叙述产物与描述现象的不同,“烟”与“雾”,“光”与“火焰”的不同,白色与无色的不同等.


科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 混合物 | 需加入的试剂 | 分离方法 |
| ①苯(苯酚) | ||
| ②乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
| t/min | 0 | 10 | 20 | 30 | 40 |
| φ(CO) | 0.250 | 0.235 | 0.225 | 0.200 | 0.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(NO3-)>c(H+)>c(OH-) | B. | c(NO3-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(NH4+)>c(NO3-)>c(OH-) | D. | c(OH-)>c(NO3-)>c(NH4+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 | |
| B. | 称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| C. | 称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| D. | 用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
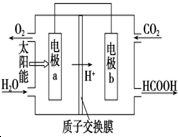 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com