
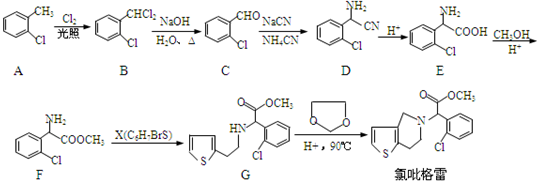
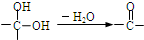 ,②
,②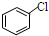 中氯原子较难水解.
中氯原子较难水解.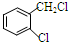 或
或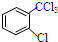 .
. .
.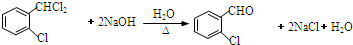 .
.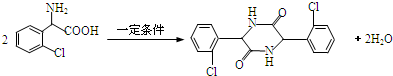 .
.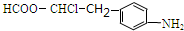 .
.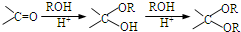 ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物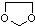 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$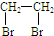
分析 E和甲醇发生酯化反应生成F,F取代反应生成G,根据F、G结构简式结合X分子式知,X结构简式为 ,G发生取代反应生成氯砒格雷,
,G发生取代反应生成氯砒格雷,
(1)A→B是甲基在光照条件下的取代反应,其是连续取代的过程,可能是1取代、2取代或3取代;
(2)E和甲醇发生酯化反应生成F;
(3)根据F、G结构简式结合X分子式知,X结构简式为 ;
;
(4)B→C是卤代烃的水解,结合题给信息解答;
(5)两分子E可在一定条件下反应,生成的有机产物分子中含有3个六元环,是2分子E生成二肽的反应;
(6)据F的结构简式和题给条件书写其同分异构体;
(7)乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,再发生水解反应生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成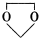 .
.
解答 解:(1)邻氯甲苯在光照条件下与氯气反应的产物有除A外还有 和
和 ,故答案为:
,故答案为: 或
或 ;
;
(2)E和甲醇发生酯化反应生成F,故答案为:取代或酯化;
(3)根据F、G结构简式结合X分子式知,X结构简式为 ,故答案为:
,故答案为: ;
;
(4)卤代烃在NaOH溶液中水解,生成2个羟基,脱水生成醛基,化学方程式为 ,
,
故答案为: ;
;
(5)2分子E生成二肽的反应的化学方程式为 ,
,
故答案为: ;
;
(6)①结构中存在氨基;
②苯环上有两种不同化学环境的氢,说明氨基和甲酯基在对位;
③能发生银镜反应,其碱性条件下水解的两种产物也能发生银镜反应,说明含有甲酯基;
其结构简式为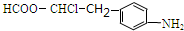 ,故答案为:
,故答案为: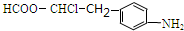 ;
;
(7)由乙烯、甲醇为有机原料制备化合物 ,首先乙烯与卤素加成生成1,2-二溴乙烷,其在NaOH的水溶液中水解生成乙二醇,甲醇氧化生成甲醛,甲醛与乙二醇反应生成
,首先乙烯与卤素加成生成1,2-二溴乙烷,其在NaOH的水溶液中水解生成乙二醇,甲醇氧化生成甲醛,甲醛与乙二醇反应生成 ,合成路线为
,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物合成,侧重考查学生分析推断及知识迁移能力,为高考高频点,能根据流程图中结构简式变化方式判断反应类型,难点是合成路线的设计,根据反应物及目标产物结合有机物中官能团及其性质设计合成路线即可,题目难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH-CHO | B. | CH3-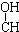 - -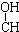 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-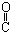 -CH2-CHO -CH2-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com