
【题目】如图所示:a为铁片、b为铜片。下列叙述不正确的是:

A. a和b是否用导线连接时,都会有金属铜析出
B. a和b用导线连接比a和b不连接的反应速率要快
C. a和b用导线连接时,铜片上反应:Cu2++2e-=Cu
D. 无论a和b用导线是否连接,铁片上产生的现象相同
【答案】D
【解析】
A.若a和b不用导线连接时,不能形成原电池,铁直接与CuSO4溶液反应置换出铜Cu2++Fe=Fe2++Cu,a极上析出铜;若a和b用导线连接时,该装置构成原电池,b为正极Cu2++2e-=Cu,b极上析出铜。所以A项正确;
B.a和b用导线连接能形成原电池,不用导线连接不能形成原电池,形成原电池能加快化学反应速率,所以B项正确;
C.a和b用导线连接时,该装置为原电池,铁为负极,铜为正极,铜片上发生还原反应:Cu2++2e-=Cu,C项正确;
D.若a和b不用导线连接时,不能形成原电池,铁片直接与CuSO4溶液反应置换出铜Cu2++Fe=Fe2++Cu,铁片上析出铜;若a和b用导线连接时,该装置构成原电池,铁片为负极,铁片发生反应Fe-2e-=Fe2+,铁片逐渐溶解,D项错误;答案选D。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
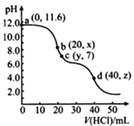
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列盐溶液水解的离子方程式
(1)次氯酸钾(KClO)溶液__________________________________________________;
(2)磷酸钠(Na3PO4)溶液___________________________________________________;
(3)明矾净水水解原理____________________________________________;
(4)硫酸铁溶液__________________________________________
(5)泡沫灭火器的原理__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有PH=12的NaOH溶液100ml,欲使其PH变为11(忽略溶液混合后体积的变化,计算结果小数点后保留一位)完成下列填空
(1)若用水稀释,则加入水的体积为_________ml
(2)若加入PH=10的NaOH溶液,应加入__________ml
(3)若加入PH=2的盐酸,应加入_________ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
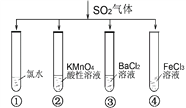
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容中反应:2NO2(g)![]() 2NO(g)+O2(g),能说明反应达平衡状态的是:
2NO(g)+O2(g),能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() =1×10-12;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是
=1×10-12;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是
A. 简单离子半径:X>Y>Z
B. 氢化物的沸点:W<X
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、C60和石墨 B、35Cl和37Cl C、![]() 和
和![]()
D、乙醇和甘油 E、CH2=CH-COOH和油酸(C17H33COOH)
①互为同位素的是______________; ②互为同系物的是_________________;
③互为同素异形体的是__________; ④互为同分异构体的是_____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com