
| 化学键 | H-H | C-O | C$\stackrel{←}{=}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |

分析 (1)反应热=反应物总键能-生成物总键能;根据盖斯定律:反应②-反应①=反应③,反应热也进行相应的计算;
(2)化学平衡常数指可逆反应得到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
化学平衡常数只受温度影响,根据温度对平衡移动的影响,进而判断温度对平衡常数影响;
(3)由图可知,压强一定时,随温度的升高,CO的转化率降低,根据升高温度对反应①、③的影响,进行分析CO转化率变化原因.
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案为:-99;+41;
(2)反应①CO(g)+2H2(g)?CH3OH(g)的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$;
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
故答案为:K=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$;a;反应①正反应为放热反应,平衡常数随温度升高而减小;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
故答案为:减小;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.
点评 本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因素、化学平衡图象综合应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
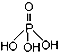 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. |  分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| C. | PETG的结构简式为: 合成PETG的单体有4种 合成PETG的单体有4种 | |
| D. | 化合物 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )④
)④ ⑤葡萄糖⑥蛋白质.
⑤葡萄糖⑥蛋白质.| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选项 | 甲 | 乙 |
| A | 物质的粒子数 | 阿伏加德罗常数 |
| B | 标况下气体的体积 | 标况下气体摩尔体积 |
| C | 固体的体积 | 固体的密度 |
| D | 溶液的物质的量浓度 | 溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2 HCL═Mg CL2+2 H2O | B. | 2 NaOH+H2SO4═Na2SO4+2 H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4+2 H2O | D. | 2 HCL+Cu(OH)2═CuCL2+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15.5 g | B. | 15.0 g | C. | 14.5 g | D. | 16.0 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com