
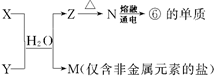
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小。请回答下列问题: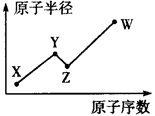
(1)写出化合物XWZ的电子式:_______________________。
(2)由W、Y两种元素组成的一种化合物M分子中,每个原子最外层均达到稀有气体的稳定结构,在工业生产中M大规模用于面粉的漂白和杀菌,写出M与水反应的化学方程式:________________。
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物N是一种常见的化肥,若N能促进水的电离,则其化学式为____________________;若N能抑制水的电离,则其化学式为___________________。
(4)XYZ3溶液的酸性比XWZ溶液的酸性强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________________________________。
(1)XWZ的电子式为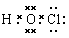 (2分)
(2分)
(2)NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O)(2分)
(3)NH4NO3(或NH4Cl)(1分);NH3·H2O(1分)
(4)不正确;HClO不是Cl的最高价氧化物对应的水化物(2分)
解析试题分析:有题意可知Y为N,Z为O,由原子序数:X<Y,原子半径:X<Y,故X为H。由原子序数:Z<W,原子半径:Z<W,且W的原子半径是同周期中最小。故W是Cl。(1)XWZ的电子式为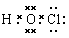 ,(2)由题意可知M为NCl3,其与水反应应生成HClO,故方程式为:NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O);(3)化合物N由三种元素组成的常见化肥,故应含有N,能促进水解的应为铵盐,为NH4NO3或NH4Cl;能抑制水解的应为NH3·H2O。(4)HClO不是Cl的最高价氧化物对应的水化物,故不正确。
,(2)由题意可知M为NCl3,其与水反应应生成HClO,故方程式为:NCl3+3H2O=3HClO+NH3(或NCl3+4H2O=3HClO+NH3·H2O);(3)化合物N由三种元素组成的常见化肥,故应含有N,能促进水解的应为铵盐,为NH4NO3或NH4Cl;能抑制水解的应为NH3·H2O。(4)HClO不是Cl的最高价氧化物对应的水化物,故不正确。
考点:考查原子结构、化学用语、化合物的性质等知识点。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如图所示。该电池的负极反应式是____________________。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为四、五、六、七主族元素简单氢化物沸点随周期变化图像,(代表氢化A、B、C、D物中另外一种元素)分析图像并回答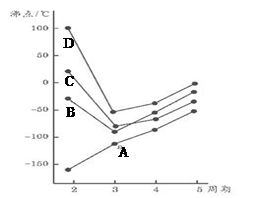
(1)写出B3-的空间构型
(2)B元素另外一种氢化物可做火箭的燃料,其电子式为:__________________,中心原子杂化方式为_______________
(3)A元素氧化物晶体类型为____________________,研究发现其氧化物晶胞中,A的位置与金刚石晶胞中碳原子位置相似,试分析晶胞中占有氧原子个数应为___________个。
(4)A、B、C、D第一电离能由小到大的顺序是____________________(用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,D ,E 。
② B、C的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出A2D的电离方程式: , 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。N P AS ;O S Se分别是VA族、VIA族连续三元素。
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D代表4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,A元素的名称是 ,该元素的原子核外共有 种不同运动状态的电子;该元素的第一电离能比后面一号元素大的原因是 。
(2)B为元素周期表中的29号元素,常与H2O、NH3等形成配合物。
B的无水硫酸盐晶体呈 色,向盛有B的硫酸盐水溶液的试管里逐滴加入氨水,首先形成 ,继续添加氨水,沉淀溶解得到 ,写出后一步反应的离子方程式 。
(3)C元素的负一价离子的电子层结构与氩相同,C的最高价氧化物的水化物的化学式为 。
(4)A元素的最高价氧化物对应的水化物的稀溶液与29号元素的单质反应的离子方程式是____________________。
(5)D元素在元素周期表的各元素中,电负性仅小于氟,A的最低价氢化物与D的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。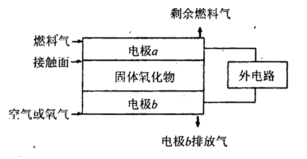
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若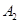 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若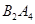 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
人民网西昌报道组10月1日电约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。

甲:嫦娥二号发射瞬间 乙:运行中的嫦娥二号
已知A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子;bB与cC两种元素存在关系:b = c﹣1;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。
请解答下列问题:
(1)A元素在元素周期表第 族中,D元素在元素周期表第 周期中。
(2)B原子的原子结构示意图: 。
(3)A、B两种元素形成的四原子分子的电子式为 。
(4)上图甲中发生反应的化学方程式为: 。
(5)A、B形成的六原子分子BA2—BA2也可以作为火箭发射中的燃烧剂,此时往往使用A、C形成的四原子分子(A2C2)作为氧化剂。已知8g BA2—BA2与足量A2C2反应,生成物均为无害气体,放出热量为160.35kJ。
请写出上述反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com