
【题目】I. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。
某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr溶液、KI(含淀粉)溶液、NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心e处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。
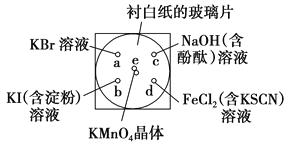
(1)e处反应的离子方程式为____________________________。
(2)b处的实验现象为_________________________________________。
(3)c处反应的化学方程式为____________________________________________。
标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是________________。
II. 据报道,有一种细菌在有氧气存在的酸性溶液中,可将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
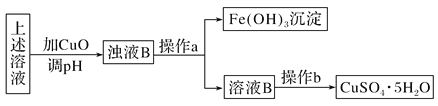
①检验溶液B中Fe3+是否被除尽的实验方法
_________________________________________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式:
方案一:_________________________________________________________;
方案二:_________________________________________________________。
【答案】 2MnO![]() +16H++10Cl-===2Mn2++5Cl2↑+8H2O 溶液由无色变为蓝色,溶液变为红色 Cl2+2NaOH===NaCl+NaClO+H2O 0.01 能 KMnO4>Cl2>FeCl3 取B中溶液少量于试管中,滴加少量KSCN溶液,若无红色出现,说明Fe3+已除尽 CuSO4+Fe===FeSO4+Cu 2CuSO4+2H2O
+16H++10Cl-===2Mn2++5Cl2↑+8H2O 溶液由无色变为蓝色,溶液变为红色 Cl2+2NaOH===NaCl+NaClO+H2O 0.01 能 KMnO4>Cl2>FeCl3 取B中溶液少量于试管中,滴加少量KSCN溶液,若无红色出现,说明Fe3+已除尽 CuSO4+Fe===FeSO4+Cu 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
【解析】I.
(1)四处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,反应方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+6Cl2↑+4H2O,离子方程式为2MnO4-+16H++10Cl-═2Mn2++6Cl2↑+4H2O。
(2)生成的氯气在a处与碘化钾反应,置换出碘,可观察到溶液由无色变为蓝色。
(3)氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,当有0.224L Cl2被NaOH溶液吸收后,即有0.01mol氯气被吸收,反应中Cl元素化合价由0价分别变化为-1价、+1价,则转移电子0.01mol。
(4)因反应2KMnO4+16HCl(浓)═2MnCl2+2KCl+6Cl2↑+4H2O,可知氧化性:KMnO4>Cl2,d处生成的氯气在d处与氯化亚铁反应,将亚铁离子氧化为铁离子,可知氧化性: Cl2>FeCl3 ,故氧化性:KMnO4>Cl2>FeCl3。
II.
①检验溶液B中Fe3+是否被除尽的试剂是KSCN溶液,加入KSCN溶液若变红证明含有铁离子,若加入后溶液不变红证明不含铁离子;
②硫酸铜溶液得到金属铜的方法,可以加入铁粉置换铜反应的化学方程式为:CuSO4+Fe=FeSO4+Cu;也可以惰性电极通电电解硫酸铜溶液,反应的化学方程式为: 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表中对应关系错误的是( )
A | NaCl===Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO42-===BaSO4↓; HCO3-+OH-===CO32-+H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色;SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH===NaCl+NaClO+H2O; 3S+6NaOH===2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、金属键、离子键和分子间作用力是微观粒子间的不同相互作用,含有上述两种相互作用的晶体是( )
A. SiO2晶体 B. Ar晶体 C. NaCl晶体 D. NaOH晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO·SiO2, 还含少量Fe2O3、A12O3、SiO2等杂质)通过如下方法制取。
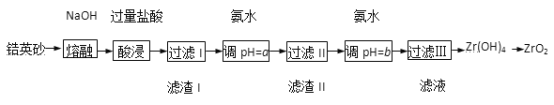
已知:ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
(1)在熔融时NaOH和ZrSiO4发生反应的化学方程式为________________,滤渣I的化学式为_______。
(2)用氨水调pH=a是为了使滤液I的杂质离子_______(填离子符号)完全沉淀,而ZrO2+不沉淀;继续加氨水至pH=b时,所发生反应的离子方程式为____________________________。
(3)过滤III所得滤液含有NH4Cl,向其中加入CaCO3粉末并加热,可得到两种气体。该反应的离子方程式为_______________。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是( )
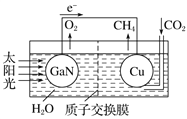
A. 该装置为原电池,且铜为负极
B. 电池工作时,H+向Cu电极移动
C. GaN电极表面的电极反应式为2H2O-4e-===O2+4H+
D. 反应CO2+2H2O![]() CH4+2O2中每消耗1 mol CO2转移4 mol e-
CH4+2O2中每消耗1 mol CO2转移4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
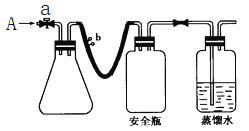
(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2,还原为Mn2+,反应的离子方程式为_____________________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2 Na2S2O3=2Na1+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是___________________________;
②用注射器抽取某水样20. 00mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入23滴_______作指示剂;
⑧用0.005 mol L -1 Na2S2O3溶液滴定至终点。滴定终点的现象是___________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________ mg L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_________ (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 无色溶液中:Na+、Cu2+、NO3-、Cl-
B. 在酸性溶液中:Na+、K+、HCO3-、Cl-
C. 在含Fe2+的溶液中:Na+、Fe3+、I-、Cl-
D. 与铝单质反应产生气体的溶液:Na+、K+、Cl- 、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com