
| A. | 金刚石和晶体硅 | B. | CO2和SiO2 | C. | KCl和HBr | D. | NaOH和NaCl |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键.
解答 解:A、金刚石和晶体硅都只含共价键的原子晶体,所以化学键类型相同,晶体类型也相同,故A正确;
B、固体CO2是分子晶体,SiO2只原子晶体,晶体类型不同,故B错误;
C、KCl是离子晶体,KCl中只含离子键,固体HBr分子晶体,HBr中只含共价键,故C错误;
D、NaOH是离子晶体,NaOH中既含离子键又含共价键,NaCl是离子晶体,NaCl中只含离子键,故D错误;
故选:A.
点评 本题考察了化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
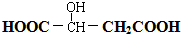 . 请回答:
. 请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2仅是还原产物 | |
| B. | Cu(IO3)2既是氧化剂又是还原剂 | |
| C. | 氧化产物与还原产物物质的量比为13:2 | |
| D. | 当1 mol氧化剂参加反应时,被氧化的物质的物质的量为11mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个水分子内含有两个氢键 | |
| B. | 只要有氢元素就能形成氢键 | |
| C. | 分子间能形成氢键使物质的熔点和沸点升高 | |
| D. | HF的稳定性很强,是因为其分子间能形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2-Cl | B. | 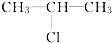 | C. | CH3CH2CH2-Br | D. | 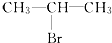 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=6.61×10-4 |
| A. | 氰化钠溶液中通入少量CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-)>c(HCN)>c(H+)>c(OH+) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液中各种离子的浓度关系有:2[c(H+)-c(OH+)]=c(CN+)-c(HCN) | |
| D. | 等体积、等浓度的NaCN和NaF溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
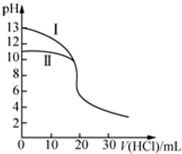
| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com