
| A. | 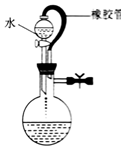 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 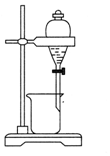 分离酒精和水 | D. | 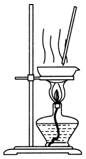 蒸干NH4Cl溶液制NH4Cl固体 |
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容容器内混合气体的密度不再变化 | |
| B. | AB3的生成速率与B2的生成速率之比为2:3 | |
| C. | 恒压容器内混合气体的总物质的量不再变化 | |
| D. | 单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量Na固体,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、CaO、Al2O3均为碱性氧化物 | |
| B. | 液溴不导电,所以液溴是非电解质 | |
| C. | 12C与13C的核外电子排布方式相同,化学性质相同 | |
| D. | 只含共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| B. | 该样品中Cu、O元素的质量比为10:l | |
| C. | V=448 | |
| D. | 溶解样品时消耗H2SO4的物质的量为0.04 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂 | B. | 阿司匹林 | C. | 矿物质 | D. | 维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一般地说,K>105时,该反应进行得就基本完全了 | |
| B. | 对一个确定的反应,K值越大,正反应进行的程度越大 | |
| C. | 在温度一定时,K与反应物或生成物的浓度变化无关 | |
| D. | 温度越高,K值越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
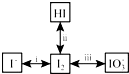
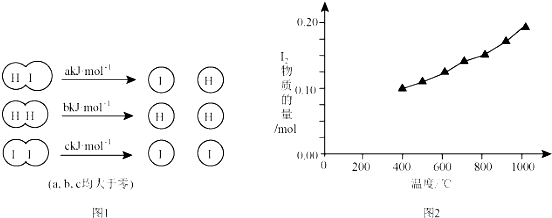
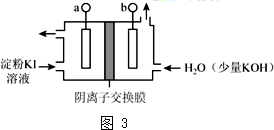
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com